Revisión de la respuesta tisular
a los materiales de relleno
Introducción
Los materiales de relleno son productos sanitarios que se aplican mediante inyección, aguja u otro sistema, con la finalidad de modificar la anatomía, corregir pliegues, arrugas o defectos de la piel, así como restablecer volúmenes.
En los últimos años los materiales de relleno han mostrado un auge considerable tanto para el uso en medicina estética (ME) como para técnicas reconstructivas, de ahí que los laboratorios se esfuercen en ofrecer a los facultativos productos de mayor duración, con menores efectos secundarios y mejores resultados. La mayoría de los productos utilizados actualmente son de colágeno y ácido hialurónico, a los que en algunos casos se añaden polímeros para enlentecer su degradación en el organismo. Otros materiales contienen partículas orgánicas (ácido poliláctico) e inorgánicas (hidroxiapatita cálcica), materiales que han sido utilizados como materiales de sutura degradables y para cementar el hueso respectivamente.
Los rellenos permanentes, como la silicona y el gel de poliacrilamida, se han utilizado durante años y todavía se utilizan en algunos países.
Además, resulta interesante desde el punto de vista de la anatomía patológica analizar la imagen histológica de los diferentes materiales de relleno, para comprender mejor su interacción e integración tisular; así como los patrones de las lesiones no deseadas secundarias a la infiltración de los distintos productos del mercado.
Por otra parte, junto con la gran variedad de productos y subproductos de relleno existentes, el número de técnicas empleadas en ME es cada vez mayor y, además, muchas veces los pacientes desconocen qué productos se les ha inyectado. Los usuarios de estos productos en las consultas de ME deben conocer las reacciones adversas publicadas en la literatura científica, así como las incluidas en las fichas técnicas de cada uno de los productos de relleno.
El objetivo del presente artículo es revisar la información existente sobre las moléculas que configuran los diferentes materiales de relleno, así como las reacciones adversas descritas en la literatura, analizar los diferentes patrones histológicos de los productos y las estrategias diagnósticas de los diferentes materiales de relleno y, por último, revisar el manejo de los efectos secundarios en caso de que aparezcan.
Metodología
Para cumplir con el objetivo se ha realizado una búsqueda bibliográfica de los artículos publicados en PubMed utilizando las siguientes palabras clave: reacción adversa a materiales de relleno, rellenos en medicina estética y rellenos dérmicos. Para sistematizar lo encontrado se ha preferido diferenciar los materiales de relleno respecto de su duración una vez implantados en el tejido.
Materiales de relleno reabsorbibles o temporales
Colágeno bovino
Molécula: composición e indicaciones
El colágeno bovino es un relleno absorbible cuyo efecto tiene una duración menor a 6 meses, aunque la longevidad del producto es variable y depende de la cantidad inyectada, el subtipo de colágeno, el estrés mecánico al que está sometida la zona, la localización y la respuesta individual1. La infiltración de colágeno bovino estimula, en el lugar del implante, la producción de colágeno endógeno que progresivamente sustituye al implantado2. Asimismo, induce en la piel una respuesta subepidérmica característica que consiste en edema y fibroplasia de la dermis papilar. Se ha utilizado durante más de 30 años como relleno inyectable en humanos, pero es necesario realizar un test de alergia antes de la inyección ya que el 3% de la población desarrolla una respuesta de hipersensibilidad retardada3.
Zyderm I® fue el primero que apareció, y se utilizó en la corrección de arrugas superficiales; debiéndose inyectar a nivel superficial. El Zyderm II® en cambio es más efectivo en arrugas de mayor profundidad. El Zyplast® es más resistente a la degradación enzimática y tiene menor capacidad inmunogénica. Se recomienda este último para líneas profundas y cicatrices.
Efectos secundarios descritos
Se han encontrado reacciones de hipersensibilidad caracterizadas por eritema, edema e induración en la zona de la infiltración, lo que indica una alergia preexistente al colágeno bovino3.
Se han descrito reacciones granulomatosas a cuerpo extraño, granulomas con empalizada tipo granuloma anular, quistes y formación de abscesos4, abscesos estériles5, hematomas, reactivaciones herpéticas, infecciones bacterianas, necrosis local, parestesias, dificultad respiratoria6 y shock anafiláctico severo7. También hay dos casos de pérdida de visión irreversible unilateral y bilateral respectivamente, por oclusión de la arteria retiniana3.
Imagen histológica del colágeno bovino
El colágeno bovino presenta unas bandas de mayor grosor que el humano, y su aspecto es más homogéneo debido a la escasa cantidad de fibroblastos entre las fibras8 (Figura 1). Carece de birrefringencia a la luz polarizada a diferencia del humano y la tinción con tricrómico de Masson le otorga una coloración gris-violeta, diferente del color verde, característico del humano8.
Colágeno humano obtenido mediante bioingeniería
Molécula: composición e indicaciones
Autologen® es una matriz tisular constituida por fibrillas de colágeno que se obtienen de la propia piel del paciente tras una exéresis quirúrgica9.
Existen otros productos obtenidos mediante cultivo de fibroblastos de donantes humanos seleccionados, que mediante bioingeniería producen colágeno tipo I y III, así como proteínas de la matriz extracelular. Se trata de Cosmoderm I®, Cosmoderm II® y Cosmoplast®. Por otra parte, Cymetra® es un tipo de colágeno humano que contiene partículas micronizadas de colágeno de cadáveres10.
Efectos secundarios descritos
Las reacciones adversas locales registradas incluyen hematomas, eritema y edema en el lugar de la inyección si bien hay pocos casos publicados de reacción granulomatosa secundaria9.
Ácido hialurónico
Molécula: composición e indicaciones
El ácido hialurónico (AH) es un polisacárido del tipo de los glicosaminglicanos, compuesto por una larga cadena de monosacáridos alternados de ácido D‑glucurónico y N‑acetil-D‑glucosamina; presente de forma natural en el cuerpo humano11. Es un componente que se encuentra en la matriz extracelular, líquido sinovial y humor vítreo entre otros. También algunas bacterias lo poseen como componente de sus cápsulas.
El AH utilizado en ME tenía dos orígenes diferentes. El de origen animal, obtenido a partir de la cresta de gallo, Hylaform®, que ya se ha dejado de comercializar. En cuanto al ácido de origen no animal estabilizado, está producido por ingeniería genética recombinante y procede de bacterias del género Streptococcus: Restylane®, Juvéderm®, Perlane®, Macrolane®, entre otros.
Efectos secundarios descritos
El AH no es específico de órgano, tejido o especie, por lo que teóricamente no existe riesgo de reacciones alérgicas tras la inyección de AH exógeno12.
Aunque se han descrito de manera aislada algunos casos de reacciones de hipersensibilidad secundarias a la inyección de AH en la cara13, se ha atribuido a las impurezas del proceso de fermentación bacteriano como ADN contaminante14.
Imagen histológica de la reacción granulomatosa frente al AH
Al microscopio óptico, el AH se observa como un material amorfo, basófilo, extracelular15 que se tiñe con azul alcián a un pH de 2,7. Es negativo al observarlo bajo luz polarizada16. Este material se rodea de abundantes células gigantes multinucleadas y se localiza en la dermis (Figura 2).
En la literatura se encuentra un caso de reacción granulomatosa eosinofílica y otro de reacción granulomatosa de tipo a cuerpo extraño formada por un material amorfo entremezclado con polimorfonucleares neutrófilos tras una infiltración de labios17,18. El tratamiento de elección para este tipo de reacciones es la infiltración intralesional de hialuronidasa19.
En la literatura se describe un caso de reacción granulomatosa causada por AH diagnosticado mediante punción-aspiración con aguja fina (PAAF) (Figura 3). Se trataba de una mujer de 65 años intervenida por cáncer de mama; en su seguimiento se identificó un nódulo submandibular de un cm que, con ecografía, era sospechoso de ganglio linfático metastásico. Tras la realización de una PAAF, se identificaron masas basófilas amorfas acompañadas de células gigantes multinucleadas e histiocitos dispersos20.
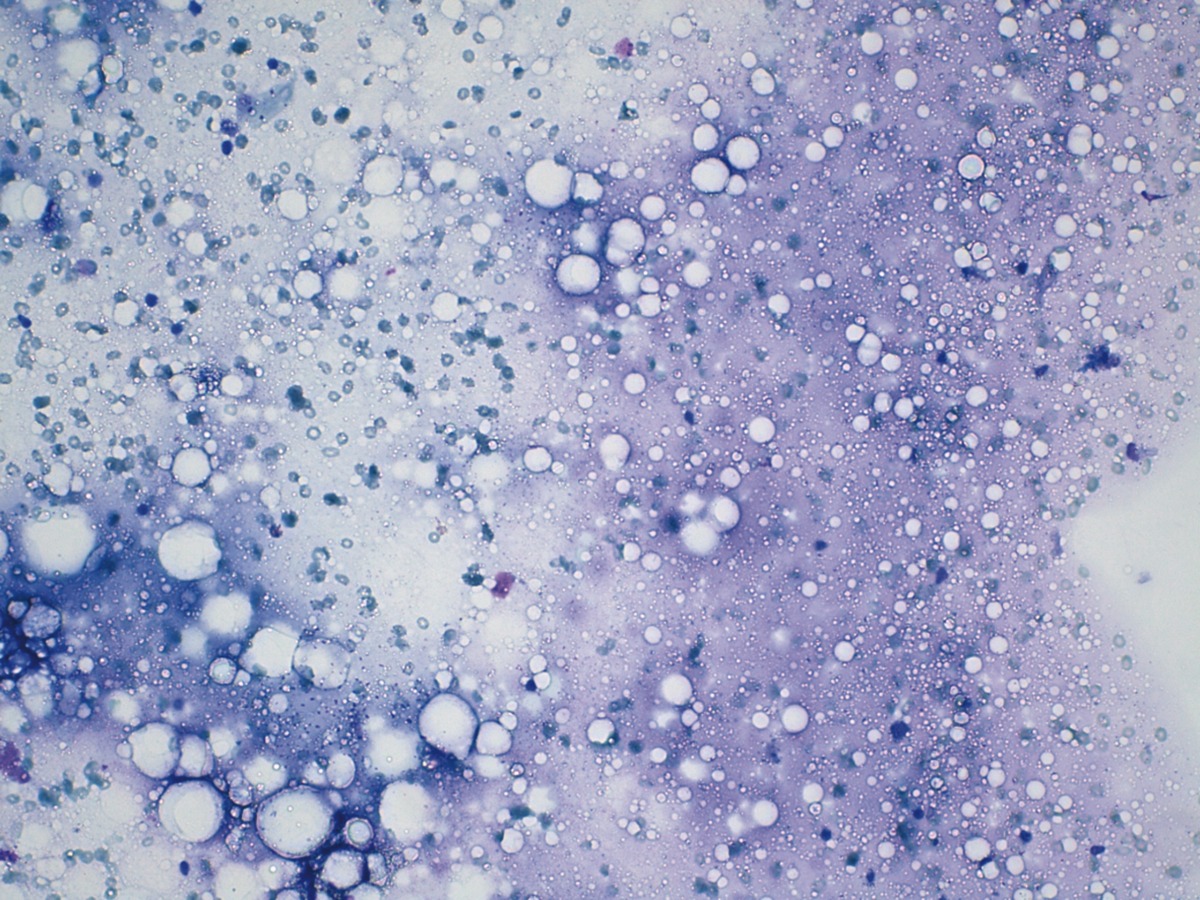
Reacciones no alérgicas
Son frecuentes las reacciones no alérgicas locales tales como edema, dolor y enrojecimiento de la zona, generalmente autolimitadas y que se resuelven en pocos días sin tratamiento. Se ha observado que las infiltraciones de AH causan más hematoma e hinchazón que las realizadas con colágeno; lo que posiblemente se deba la similitud estructural entre el AH y la heparina.
También se han descrito, pero infrecuentemente reactivaciones de VHS, infecciones bacterianas, abscesos asépticos21, esclero-mixedema localizado22, sarcoidosis cicatricial23, sarcoidosis sistémica inducida por interferón en paciente con VHC crónica24 y necrosis con patrón tipo livedo reticularis tras embolización arterial accidental25.
Ácido hialurónico con microesferas de dextranómero
Molécula: composición e indicaciones
El AH con microesferas de dextranómero (Matridex®, Reviderm intra®) es un nuevo material de relleno absorbible compuesto por AH no animal estabilizado y microesferas de dextrano de 80‑120 μm de diámetro con una carga superficial positiva26.
Efectos secundarios descritos
Únicamente se ha descrito un caso de reacción granulomatosa causada por Matridex® en una paciente de 43 años que desarrolló 4 semanas después de la infiltración del producto nódulos eritematosos en ambas mejillas y zona periorbitaria27.
Reacción granulomatosa frente a Matridex®: imagen histológica
El corte histológico mostró un material filamentoso azul grisáceo constituido por el AH, entremezclado con partículas de color azul intenso, esféricas y de configuración bizarra, que representan las microesferas de dextranómero.
Hidroxiapátita cálcica
Molécula: composición e indicaciones
La hidroxiapatita cálcica (Radiance FN® y Radiesse®) es un relleno absorbible compuesto por microesferas sintéticas de hidroxiapatita cálcica suspendidas en un gel vector de carboximetilcelulosa sódico, en una proporción de 30% y 70% respectivamente.
Inicialmente produce un aumento de volumen debido al gel vector y posteriormente se produce una neo-colagenogénesis, estimulando gradualmente la producción de colágeno del propio paciente. El producto tiene una textura que remeda el tejido conectivo nativo y con una capacidad de migración mínima.
Tras la infiltración del producto en pocos meses se produce un nódulo palpable, causado por una respuesta macrofágica junto a una neoformación de colágeno alrededor de las microesferas que presenta una duración de entre 9 y 12 meses28.
Efectos secundarios descritos
Se ha descrito una alta incidencia de nódulos en las infiltraciones labiales29, migración del producto a distancia del lugar en el que fue infiltrado30 y reacciones granulomatosas de tipo a cuerpo extraño16.
Reacción tisular frente a la hidroxiapatita cálcica: imagen histológica
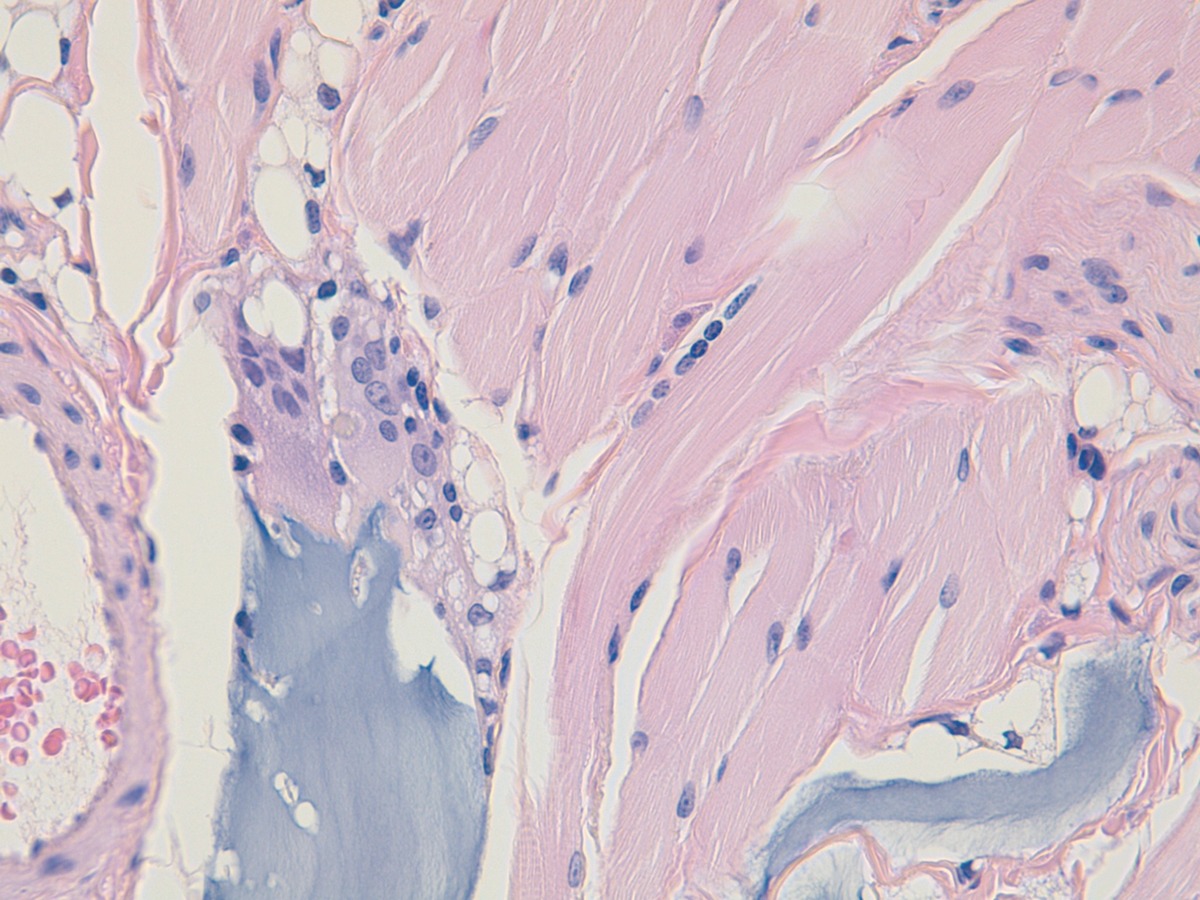
La reacción tisular consiste en un agregado de escasos macrófagos alrededor de las microesferas, más que una reacción granulomatosa de tipo a cuerpo extraño31, lo que sugiere que el producto se elimina mediante una degradación enzimática más que por fagocitosis de las microesferas.
Las microesferas se observan aglomeradas, redondas, ovales y espiculadas, de coloración azulada, con un diámetro de 25‑40 micras, rodeadas de fibras de fibrina y escasa celularidad inflamatoria.
Ácido poliláctico
Molécula: composición e indicaciones
El ácido poliláctico (APL) (Sculptra®, New Fill®) es un material de relleno sintético, biocompatible y biodegradable que se debe inyectar en dermis reticular o tejido celular subcutáneo, reabsorbible que induce un aumento de volumen, con una permanencia de unos 24 meses.
Tras la inyección del relleno el aumento de volumen en el tejido no es inmediato, sino que comienza a los 3 meses, cuando se inicia la disolución del APL y se produce el sobrecrecimiento de colágeno tipo I32. El efecto es máximo transcurridos 5‑6 meses. El APL se degrada gradualmente entre los 9 a 24 meses post-inyección33. No obstante, la neoformación de colágeno producida en dermis permanece y el aumento de volumen en la zona tratada es notable hasta los 24 meses32.
Efectos secundarios
Se han descrito en un 30‑40% de los pacientes la aparición de nódulos en el lugar de la inyección. Los nódulos no son visibles, en la mayoría de los casos, pero sí palpables y persisten meses o incluso años34. También se han descrito pápulas visibles que suelen desaparecer espontáneamente en semanas.
De la misma manera que con otros productos se producen respuestas locales a corto plazo: eritema, hinchazón, dolor, inflamación o prurito, que desaparecen espontáneamente en unos días. Un artículo en la literatura recoge reacciones adversas de mayor gravedad, como las infecciones de aparición tardía y la reacción granulomatosa a cuerpo extraño en la biopsia35. También hay un caso publicado de reacción adversa sistémica por shock anafiláctico36.
Reacción tisular frente al APL: imagen histológica
Al microscopio óptico el material se observa en forma de partículas translúcidas, de morfología fusiforme, oval o espiculada. Es característica la heterogeneidad en el tamaño de las partículas. Al observarlas con luz polarizada muestran birrefringencia. Alrededor de las partículas se disponen abundantes células gigantes multinucleadas y algunas de ellas engloban individualmente alguna partícula cristaloidea.
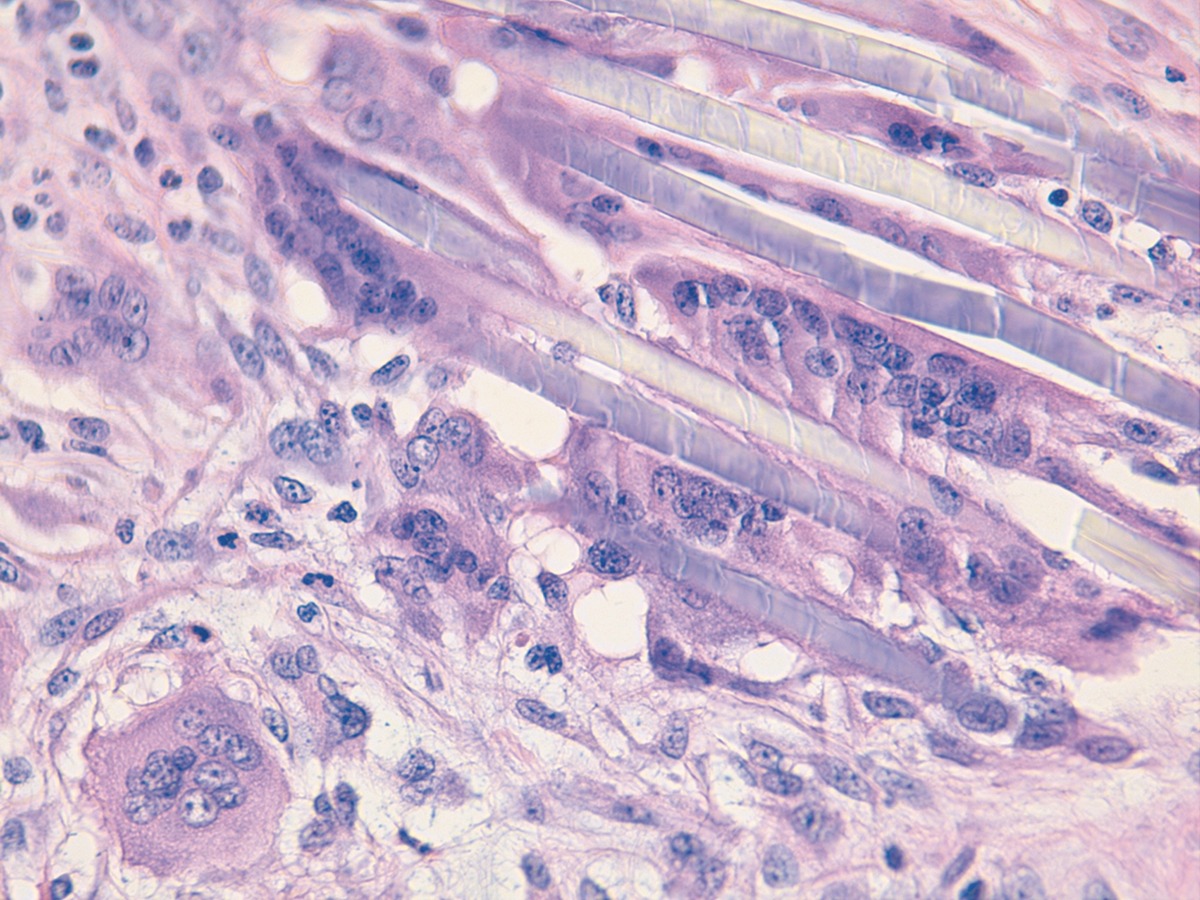
La gran semejanza con la respuesta provocada por los hilos de sutura reabsorbibles (Figura 4) es una característica clave para su diagnóstico. En el caso de que se produzca una reacción granulomatosa a cuerpo extraño frente a las partículas de APL, se identifican en dermis gran cantidad de células gigantes multinucleadas alrededor de los cristaloides, pudiendo permanecer hasta 28 meses post-inyección15.
Cómo reducir la frecuencia de aparición de nódulos
Es tal la frecuencia de aparición de nódulos en el lugar de la infiltración del producto que algunos investigadores37 han realizado estudios para reducir su aparición, observando que disminuye la frecuencia de nódulos si:
- El producto lleva reconstituido 36‑48 horas, mejor que si han pasado sólo 2‑12 horas.
- Se aumenta el volumen de reconstitución, mejor con 5‑6 ml que con 3‑4.
- Se inyecta el producto en tejido celular subcutáneo y no en dermis reticular o profunda.
- Se realiza un masaje post-inyección y se recomienda al paciente que lo realice 5 veces al día durante 5 días.
Materiales de relleno semi-permanentes
Microesferas de polimetil-metacrilato con colágeno bovino
Molécula: composición e indicaciones
Artecoll®, Arteplast® y Artefill® eran materiales de relleno bifásicos, compuestos por una parte sólida permanente representada por microesferas de polimetil-metacrilato (PMMA) de 30‑42 μm suspendidas en una solución de colágeno bovino. La parte líquida reabsorbible hace de vector, en proporción 4:1. Ya no se comercializa desde el año 2010.
El PMMA se utilizó en principio para prótesis dentales y como cemento óseo, siendo utilizado en Europa desde 1994 como material de relleno para la corrección de arrugas faciales, líneas periorales, aumento de labios y depresiones cicatriciales.
Efectos secundarios
Los efectos secundarios descritos se pueden subdividir en función del componente del material responsable de la respuesta. El colágeno bovino requiere un test de alergia previo, debido a que hay un 3‑4% de población con alergia al mismo. De hecho, hay un caso de shock anafiláctico tras la octava sesión de infiltración del producto38. Por otro lado, las microesferas de PMMA inducen una reacción granulomatosa de tipo a cuerpo extraño con fibroesclerosis asociada, que en parte es el efecto deseado.
Debe implantarse en dermis reticular, ya que si se coloca en hipodermis el relleno no tendrá efecto y si, por el contrario, se implanta demasiado superficial se producirá un nódulo blanquecino que a su vez provocará una reacción a cuerpo extraño más evidente de lo deseado.
Se estima que en un 3% de los casos, este material provoca algunos efectos indeseables como telangiectasias, cicatrices hipertróficas, reacciones alérgicas y granulomas que suelen aparecer entre 4 y 24 meses tras la inyección, aunque se han descrito casos de aparición tardía, tras varios años39,40.
Reacción tisular frente al PMMA: imagen histológica
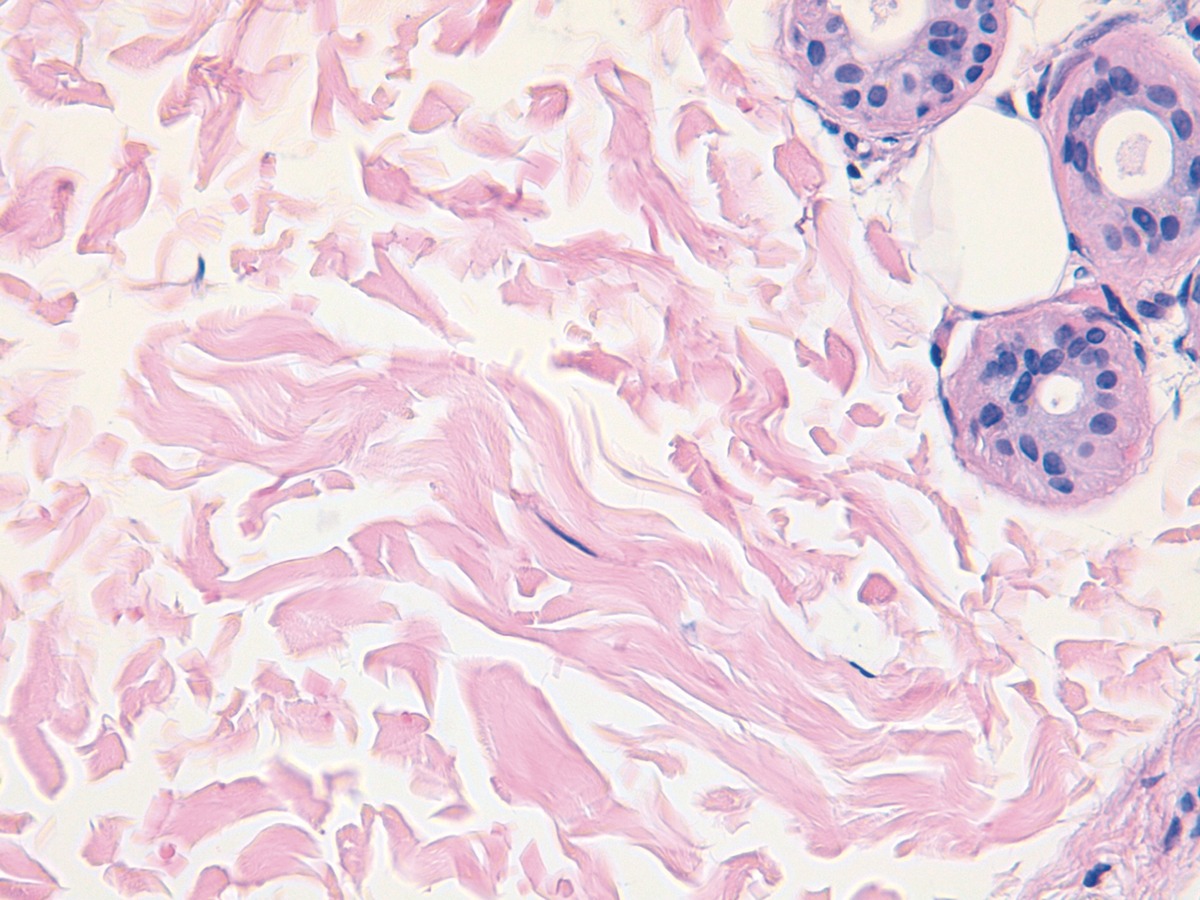
Los granulomas secundarios a Artecoll® se localizan en la dermis, grasa subcutánea, glándulas sudoríparas e incluso músculo esquelético.
La imagen histológica se describe como un infiltrado nodular o difuso constituido por vacuolas redondeadas homogéneas similares a los adipocitos (Figura 5). Son de contornos redondeados y nítidos, vacías de contenido, sin birrefringencia y de localización característica extracelular. Se acompañan de histiocitos epitelioides, células gigantes multinucleadas, linfocitos y eosinófilos. Se rodean a su vez de un estroma escleroso.
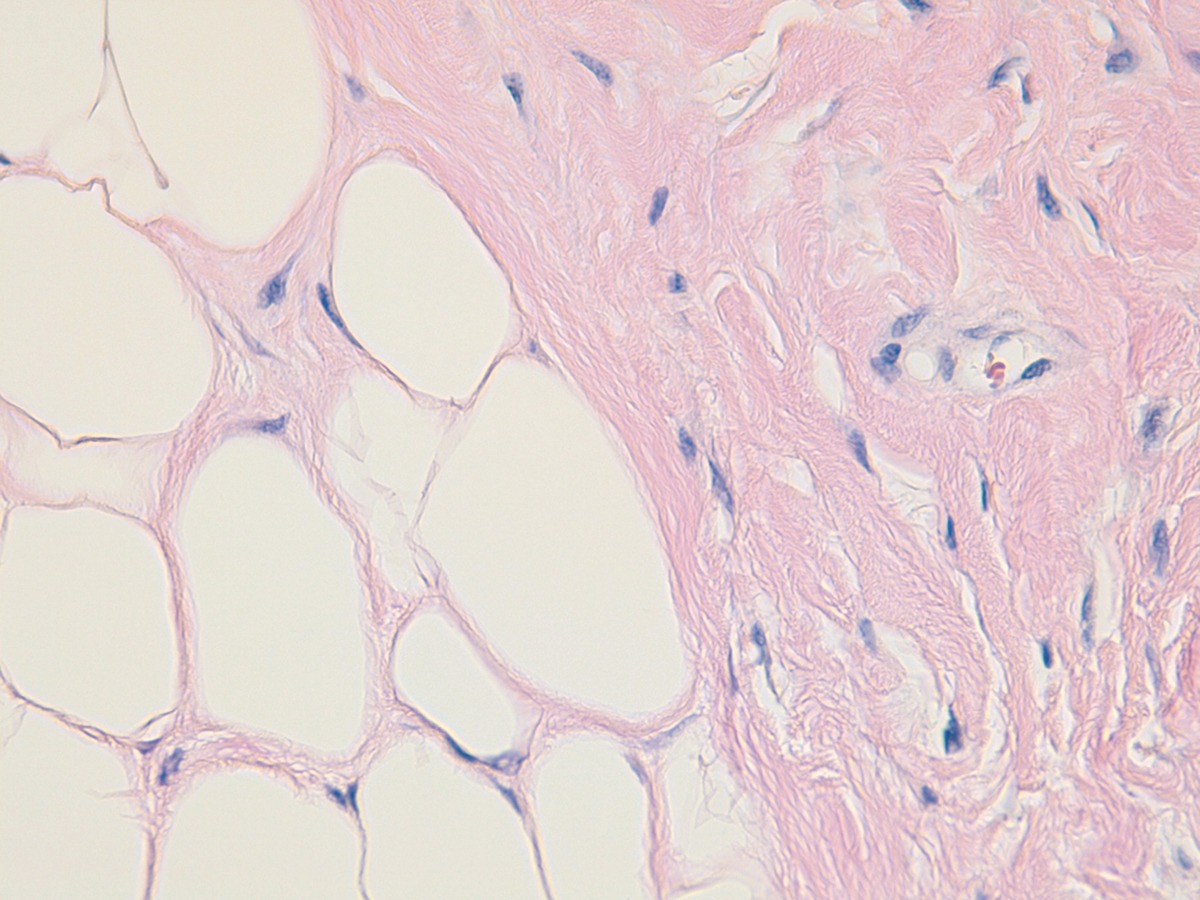
El manejo de estos nódulos consiste en la inyección intralesional de triamcinolona con lidocaína (1:3), aunque también se han tratado casos con Alopurinol® o 5‑Fluorouracilo®.
Hidroximetilmetacrilato / fragmentos de etilmetacrilato con AH
Molécula: composición e indicaciones
Dermalive® y Dermadeep® eran materiales de relleno bifásicos. El 40% es un hidrogel acrílico de etilmetacrilato (EMA) e hidroxietilmetacrilato (HEMA) y el 60% es AH producido mediante técnicas de ingeniería microbiológica. El AH hace de vector y dura unos 3 meses, mientras que los fragmentos de EMA y HEMA persisten durante años. La fecha de cese comercial fue el 24/05/2007.
El hidrogel acrílico de Dermalive® es el mismo que se ha utilizado para lentes intraoculares en cataratas. Debía infiltrarse en dermis reticular o unión dermo-subcutánea, para la corrección de arrugas faciales, líneas periorales, y cicatrices deprimidas. Dermadeep® por su parte, se utilizaba para defectos cutáneos de mayor profundidad y dimensión que el anterior.
Efectos secundarios
Los efectos adversos inmediatos son similares a los descritos en los demás materiales de relleno: eritema, dolor, edema y hematomas, que desaparecen espontáneamente en pocos días. Los efectos adversos a largo plazo tienen una incidencia variable según la literatura y aparecen unos meses después de la infiltración como nódulos e induraciones en el tejido41.
Reacción tisular frente a Dermalive®: imagen histológica
Las partículas del hidrogel acrílico de Dermalive® son sólidas, poligonales, translúcidas y de manera intencionada sus contornos son irregulares y angulosos, pero de superficie lisa, con un tamaño de entre 45 y 65 μm.
La imagen histológica de la reacción granulomatosa producida por Dermalive® se corresponde a pequeño aumento con infiltrados granulomatosos nodulares que afectan dermis reticular e hipodermis. La epidermis y dermis papilar en general están intactas. A mayor aumento se identifican estructuras pseudoquísticas de formas y tamaños heterogéneas que contienen cuerpos extraños poligonales, rosados y translúcidos, que dan una imagen típica de “gravilla”15,35. Estas partículas se rodean de numerosos histiocitos epitelioides, células gigantes multinucleadas y algunos linfocitos. Se observan abundantes cuerpos asteroides en el interior de las células gigantes. También se ha descrito la eliminación transepidérmica del producto15. La inyección intralesional de corticoesteroides y 5‑Fluorouracilo ha resultado eficaz en el tratamiento de los nódulos.
Materiales de relleno permanentes
Hidrogel de poliacrilamida
Molécula: composición e indicaciones
Aquamid®, Interfall®, OutLine®, Royamid®, Formacryl®, Amazingel®, Bio‑Formacryl® y Kosmogel® son hidrogeles de poliacrilamida. Están compuestos en un 2,5% de polímero de poliacrilamida y en un 97,5% de agua.
Se utilizaron durante mucho tiempo en China, Ucrania y Rusia para el aumento de pecho, nalgas y muslos. En Europa se utilizaron en pacientes con lipoatrofia facial asociada al tratamiento con antirretrovirales o para malformaciones faciales adquiridas o congénitas.
Efectos secundarios descritos
Tras la infiltración de cantidades moderadas o grandes de poliacrilamida bajo presión, se produce una reacción granulomatosa de tipo a cuerpo extraño, aunque clínicamente no están en contacto con estos grandes depósitos42. En cambio, tras la infiltración de pequeñas cantidades de poliacrilamida se han descrito nódulos, relacionados con infecciones bacterianas43.
Otros efectos secundarios se producen tras infiltraciones para el aumento de pecho: infecciones, hematomas, induraciones, mastodinia, parestesias en la piel, migración del gel y linfadenitis reactiva axilar44. También se han descrito casos más severos de erosión ósea y ulceración facial45.
Reacción tisular frente al hidrogel de poliacrilamida: imagen histológica
El estudio histológico de los granulomas producidos por poliacrilamida muestra granulomas de tipo a cuerpo extraño con macrófagos, células gigantes multinucleadas, linfocitos y eosinófilos rodeando el hidrogel de poliacrilamida. Ópticamente el hidrogel de poliacrilamida se parece al AH, aunque el infiltrado inflamatorio en la poliacrilamida es mayor. La tinción con azul alcián es positiva; sin embargo, no presenta birrefringencia bajo el microscopio de luz polarizada.
Se ha descrito un caso en el que la biopsia en mejilla de una paciente a la que se realizó un implante con poliacrilamida fue informado como simulador de carcinoma mucoepidermoide46.
Gel de polialquilamida
Molécula: composición e indicaciones
Bio-Alcamid® es un gel hidrófilo, permanente, traslúcido, compuesto por polímero de polialquilimida en un 4% y agua estéril en un 96%.
Se ha utilizado como relleno de mejillas en pacientes con lipoatrofia facial secundaria al tratamiento con antirretrovirales y para el aumento de glúteos. También para corregir irregularidades tras las lipoesculturas, cicatrices deprimidas, atrofia subcutánea post-traumática, pectum excavatum y malformaciones óseas.
Efectos secundarios descritos
Las complicaciones producidas por la infiltración de Bio‑Alcamid incluyen edema, hematomas, nódulos y particularmente infecciones47.
No se han descrito granulomas secundarios, pero sí abscesos de aparición tardía en pacientes con VIH con lipoatrofia facial secundaria al tratamiento con antirretrovirales47.
Reacción tisular frente al gel de polialquilamida: imagen histológica
El estudio microscópico de las lesiones nodulares en los lugares en los que se había infiltrado gel de polialquilimida mostró un material amorfo, basófilo, que se corresponde con el producto, rodeado de histiocitos epitelioides, células gigantes, polimorfonuclears neutrófilos y células eosinofílicas47.
Discusión
Según todas las informaciones analizadas, generalmente las complicaciones producidas por los rellenos biodegradables o absorbibles desaparecen espontáneamente a los pocos meses y son de menor gravedad, sin embargo, los rellenos permanentes o de larga duración pueden provocar reacciones severas irreversibles, además de requerir tratamiento farmacológico.
El tratamiento de las reacciones adversas producidas por rellenos permanentes es con frecuencia inefectivo y la única posibilidad terapéutica es la exéresis quirúrgica del agente inyectado, aunque no siempre es posible.
Por otra parte, el estudio anatomo-patológico de las lesiones cutáneas es el procedimiento de referencia para identificar el material de relleno responsable de la reacción adversa, ya que cada producto tiene unas características microscópicas específicas. La ecografía es otra forma de identificar el agente responsable de las lesiones secundarias cuando se hayan inyectado diferentes productos. Como primera opción sería recomendable la realización de una ecografía, seguida de PAAF de la lesión para el diagnóstico del producto, de esta forma el paciente no tiene que ser sometido a la toma de biopsia, evitándose la aparición de un área cicatricial en la zona.
Desde el punto de vista morfológico, las moléculas que conforman los materiales de relleno son, en el caso de los productos absorbibles, similares a los componentes del tejido; en el caso de los semi-permanentes se identifican fácilmente como material exógeno la fracción permanente y en el caso de Bio‑Alcamid® y Aquamid® el producto se asemeja a las estructuras tisulares normales.
Con respecto a las reacciones adversas, la reacción granulomatosa de tipo a cuerpo extraño es la más frecuente. En cuanto al manejo de los efectos adversos, en la mayoría de casos es fundamental el tiempo. En el caso del AH se puede inyectar hialuronidasa. En el caso del APL hay publicaciones con recomendaciones preventivas para reducir la frecuencia de aparición de nódulos.
Bibliografía
- Robinson JK, Hanke CW. Injectable collagen implant: histopathologic identification and longevity of correction. J Dermatol Surg Oncol. 1985 Feb;11(2):124‑30. https://doi.org/10.1111/j.1524-4725.1985.tb02979.x
- Stegman SJ, Chu S, Bensch K, Armstrong R. A light and electron microscopic evaluation of Zyderm collagen and Zyplast implants in aging human facial skin. A pilot study. Arch Dermatol. 1987 Dec;123(12):1644‑9. https://doi.org/10.1001/archderm.1987.01660360072015
- Kamer FM, Churukian MM. Clinical use of injectable collagen. A three-year retrospective review. Arch Otolaryngol. 1984 Feb;110(2):93‑8. https://doi.org/10.1001/archotol.1984.00800280027008
- Barr RJ, Stegman SJ. Delayed skin test reaction to injectable collagen implant (Zyderm). The histopathologic comparative study. J Am Acad Dermatol. 1984 Apr;10(4):652‑8. https://doi.org/10.1016/s0190-9622(84)80273‑x
- Hanke CW, Higley HR, Jolivette DM, Swanson NA, Stegman SJ. Abscess formation and local necrosis after treatment with Zyderm or Zyplast collagen implant. J Am Acad Dermatol. 1991 Aug;25(2 Pt 1):319‑26. https://doi.org/10.1016/0190-9622(91)70200‑l
- Douglas RS, Donsoff I, Cook T, Shorr N. Collagen fillers in facial aesthetic surgery. Facial Plast Surg. 2004 May;20(2):117‑23. https://doi.org/10.1055/s-2004‑861751
- Mullins RJ, Richards C, Walker T. Allergic reactions to oral, surgical and topical bovine collagen. Anaphylactic risk for surgeons. Aust N Z J Ophthalmol. 1996 Aug;24(3):257‑60. https://doi.org/10.1111/j.1442-9071.1996.tb01589.x
- Stegman S, Chu S, Armstrong R. Adverse reactions to bovine collagen implant: clinical and histologic features. J Dermatol Surg Oncol 1988;14(suppl):39‑48. https://doi.org/10.1111/j.1524-4725.1988.tb04039.x
- Sclafani AP, Romo T 3rd, Jacono AA, McCormick S, Cocker R, Parker A. Evaluation of acellular dermal graft in sheet (AlloDerm) and injectable (micronized AlloDerm) forms for soft tissue augmentation. Clinical observations and histological analysis. Arch Facial Plast Surg. 2000 Apr‑Jun;2(2):130‑6. https://doi.org/10.1001/archfaci.2.2.130
- Sclafani AP, Romo T 3rd, Jacono AA. Rejuvenation of the aging lip with an injectable acellular dermal graft (Cymetra). Arch Facial Plast Surg. 2002 Oct‑Dec;4(4):252‑7. https://doi.org/10.1001/archfaci.4.4.252
- Goa KL, Benfield P. Hyaluronic acid. A review of its pharmacology and use as a surgical aid in ophthalmology, and its therapeutic potential in joint disease and wound healing. Drugs. 1994 Mar;47(3):536‑66. https://doi.org/10.2165/00003495-199447030‑00009
- Larsen NE, Pollak CT, Reiner K, Leshchiner E, Balazs EA. Hylan gel biomaterial: dermal and immunologic compatibility. J Biomed Mater Res. 1993 Sep;27(9):1129‑34. https://doi.org/10.1002/jbm.820270903
- Lupton JR, Alster TS. Cutaneous hypersensitivity reaction to injectable hyaluronic acid gel. Dermatol Surg. 2000 Feb;26(2):135‑7. https://doi.org/10.1046/j.1524-4725.2000.99202.x
- Pinheiro MV, Bagatin E, Hassun KM, Talarico S. Adverse effect of soft tissue augmentation with hyaluronic acid. J Cosmet Dermatol. 2005 Sep;4(3):184‑6. https://doi.org/10.1111/j.1473-2165.2005.00309.x
- Zimmermann US, Clerici TJ. The histological aspects of fillers complications. Semin Cutan Med Surg. 2004 Dec;23(4):241‑50. https://doi.org/10.1016/j.sder.2004.09.004
- Dadzie OE, Mahalingam M, Parada M, El Helou T, Philips T, Bhawan J. Adverse cutaneous reactions to soft tissue fillers--a review of the histological features. J Cutan Pathol. 2008 Jun;35(6):536‑48. https://doi.org/10.1111/j.1600-0560.2007.00853.x
- Okada S, Okuyama R, Tagami H, Aiba S. Eosinophilic granulomatous reaction after intradermal injection of hyaluronic acid. Acta Derm Venereol. 2008;88(1):69‑70. https://doi.org/10.2340/00015555-0324
- Fernández-Aceñero MJ, Zamora E, Borbujo J. Granulomatous foreign body reaction against hyaluronic acid: report of a case after lip augmentation. Dermatol Surg. 2003 Dec;29(12):1225‑6. https://doi.org/10.1111/j.1524-4725.2003.29392.x
- Brody HJ. Use of hyaluronidase in the treatment of granulomatous hyaluronic acid reactions or unwanted hyaluronic acid misplacement. Dermatol Surg. 2005 Aug;31(8 Pt 1):893‑7. https://doi.org/10.1097/00042728-200508000‑00001
- Al-Shraim M, Jaragh M, Geddie W. Granulomatous reaction to injectable hyaluronic acid (Restylane) diagnosed by fine needle biopsy. J Clin Pathol. 2007 Sep;60(9):1060‑1. https://doi.org/10.1136/jcp.2007.048330
- Shafir R, Amir A, Gur E. Long-term complications of facial injections with Restylane (injectable hyaluronic acid). Plast Reconstr Surg. 2000 Oct;106(5):1215‑6. https://doi.org/10.1097/00006534-200010000‑00048
- Rongioletti F, Cattarini G, Sottofattori E, Rebora A. Granulomatous reaction after intradermal injections of hyaluronic acid gel. Arch Dermatol. 2003 Jun;139(6):815‑6. https://doi.org/10.1001/archderm.139.6.815
- Dal Sacco D, Cozzani E, Parodi A, Rebora A. Scar sarcoidosis after hyaluronic acid injection. Int J Dermatol. 2005 May;44(5):411‑2. https://doi.org/10.1111/j.1365-4632.2005.01930.x
- Descamps V, Landry J, Francès C, Marinho E, Ratziu V, Chosidow O. Facial cosmetic filler injections as possible target for systemic sarcoidosis in patients treated with interferon for chronic hepatitis C: two cases. Dermatology. 2008;217(1):81‑4. https://doi.org/10.1159/000128281
- Schanz S, Schippert W, Ulmer A, Rassner G, Fierlbeck G. Arterial embolization caused by injection of hyaluronic acid (Restylane). Br J Dermatol. 2002 May;146(5):928‑9. https://doi.org/10.1046/j.1365-2133.2002.04707.x
- Consulting Room. Matridur® and Matridex® information and background. Available at: https://www.consultingroom.com
- Massone C, Horn M, Kerl H, Ambros-Rudolph CM, Giovanna Brunasso AM, Cerroni L. Foreign body granuloma due to Matridex injection for cosmetic purposes. Am J Dermatopathol. 2009 Apr;31(2):197‑9. https://doi.org/10.1097/DAD.0b013e318194816d
- Marmur ES, Phelps R, Goldberg DJ. Clinical, histologic and electron microscopic findings after injection of a calcium hydroxylapatite filler. J Cosmet Laser Ther. 2004 Dec;6(4):223‑6. https://doi.org/10.1080/147641704100003048
- Duffy DM. Complications of fillers: overview. Dermatol Surg. 2005 Nov;31(11 Pt 2):1626‑33. https://doi.org/10.2310/6350.2005.31251
- Beer KR. Radiesse nodule of the lips from a distant injection site: report of a case and consideration of etiology and management. J Drugs Dermatol. 2007 Aug;6(8):846‑7.
- Drobeck HP, Rothstein SS, Gumaer KI, Sherer AD, Slighter RG. Histologic observation of soft tissue responses to implanted, multifaceted particles and discs of hydroxylapatite. J Oral Maxillofac Surg. 1984 Mar;42(3):143‑9. https://doi.org/10.1016/s0278-2391(84)80024‑5
- Vleggaar D, Bauer U. Facial enhancement and the European experience with Sculptra (poly‑l-lactic acid). J Drugs Dermatol. 2004 Sep‑Oct;3(5):542‑7.
- Athanasiou KA, Niederauer GG, Agrawal CM, Landsman AS. Applications of biodegradable lactides and glycolides in podiatry. Clin Podiatr Med Surg. 1995 Jul;12(3):475‑95.
- Levy RM, Redbord KP, Hanke CW. Treatment of HIV lipoatrophy and lipoatrophy of aging with poly‑L-lactic acid: a prospective 3‑year follow-up study. J Am Acad Dermatol. 2008 Dec;59(6):923‑33. https://doi.org/10.1016/j.jaad.2008.07.027
- Lombardi T, Samson J, Plantier F, Husson C, Küffer R. Orofacial granulomas after injection of cosmetic fillers. Histopathologic and clinical study of 11 cases. J Oral Pathol Med. 2004 Feb;33(2):115‑20. https://doi.org/10.1111/j.1600-0714.2004.00194.x
- Azizzadeh B. Late-onset infections and granuloma formation after facial polylactic acid (new‑fill) injections in women who are heavy smokers. Plast Reconstr Surg. 2009 Jul;124(1):316‑317. https://doi.org/10.1097/PRS.0b013e3181a83772
- Lam SM, Azizzadeh B, Graivier M. Injectable poly‑L-lactic acid (Sculptra): technical considerations in soft-tissue contouring. Plast Reconstr Surg. 2006 Sep;118(3 Suppl):55S‑63S. https://doi.org/10.109701.prs.0000234612.20611.5a
- Apikian M, Roberts S, Goodman GJ. Adverse reactions to polylactic acid injections in the periorbital area. J Cosmet Dermatol. 2007 Jun;6(2):95‑101. https://doi.org/10.1111/j.1473-2165.2007.00303.x
- Goldan O, Garbov-Nardini G, Regev E, Orenstein A, Winkler E. Late-onset infections and granuloma formation after facial polylactic acid (New‑Fill) injections in women who are heavy smokers. Plast Reconstr Surg. 2008 May;121(5):336e‑338e. https://doi.org/10.1097/PRS.0b013e31816b1234
- Alcalay J, Alkalay R, Gat A, Yorav S. Late-onset granulomatous reaction to Artecoll. Dermatol Surg. 2003 Aug;29(8):859‑62. https://doi.org/10.1046/j.1524-4725.2003.29233.x
- Bergeret-Galley C, Latouche X, Illouz YG. The value of a new filler material in corrective and cosmetic surgery: DermaLive and DermaDeep. Aesthetic Plast Surg. 2001 Jul‑Aug;25(4):249‑55. https://doi.org/10.1007/s002660010131
- Christensen LH, Breiting VB, Aasted A, Jørgensen A, Kebuladze I. Long-term effects of polyacrylamide hydrogel on human breast tissue. Plast Reconstr Surg. 2003 May;111(6):1883‑90. https://doi.org/10.1097/01.PRS.0000056873.87165.5A
- Christensen L, Breiting V, Vuust J, Hogdall E. Adverse reactions following injection with a permanent facial filler polyacrylamide hydrogel (Aquamid): causes and treatment. Eur J Plast Surg 2006;28:464‑71. https://doi.org/10.1007/s00238-005‑0005‑2
- Christensen L. Normal and pathologic tissue reactions to soft tissue gel fillers. Dermatol Surg. 2007 Dec;33 Suppl 2:S168‑75. https://doi.org/10.1111/j.1524-4725.2007.33357.x
- Liu HL, Cheung WY. Complications of polyacrylamide hydrogel (PAAG) injection in facial augmentation. J Plast Reconstr Aesthet Surg. 2010 Jan;63(1):e9‑12. https://doi.org/10.1016/j.bjps.2009.05.013
- Karagozoglu KH, van der Waal I. Polyacrylamide soft tissue filler nodule mimicking a mucoepidermoid carcinoma. Int J Oral Maxillofac Surg. 2008 Jun;37(6):578‑80. https://doi.org/10.1016/j.ijom.2008.01.008
- Serrano C, Serrano S. Delayed infection after Bio-alcamid implantation [in Spanish]. Actas Dermosifiliogr 2006;97:460‑2. https://doi.org/10.1016/S0001-7310(06)73441‑X
