Toxina botulínica.
¿Por qué dura menos?
Una revisión desde nuestra experiencia
A review from our experience
Introducción
La duración de los efectos relajantes de la toxina botulínica (TB) aplicada a los pacientes es una preocupación que cada vez tienen más médicos estéticos. Es frecuente oír que, al realizar un nuevo tratamiento de TB, con la misma marca de toxina que la vez anterior, en esta ocasión la duración del efecto ha sido menor. Siendo la TB el tratamiento más empleado en medicina estética1,2, es importante dilucidar si esto es cierto y las posibles causas que pueden explicar un acortamiento temporal en la duración del efecto de la TB.
La TB es una proteína producida por una bacteria anaeróbica, grampositiva y con capacidad de producir esporas, que es Clostridium botulinum. Es uno de los venenos biológicos más potentes. La toxina producida por la bacteria es una mezcla compleja de proteínas neurotóxicas y no neurotóxicas. El efecto neurotóxico se debe a la inhibición de la liberación de neurotransmisores.
La TB entra en la neurona a través de las vesículas sinápticas de la glicoproteína 2 (SV2)3,4, comprobado al demostrar que la TB‑A no se internaliza si las proteínas SV2 son inhibidas, volviendo a cumplir su función cuando su expresión queda nuevamente restaurada (Figura 1). En caso del serotipo A, la inmunomicroscopía electrónica ha demostrado cómo la neurotoxina se internaliza dentro de estas vesículas sinápticas para alcanzar el citosol neuronal. Cada vesícula puede contener una o dos moléculas de TB, cantidad regulada por las proteínas SV25,6. Es importante recalcar la especificidad de los diferentes subtipos de neurotoxina hacia las isoformas de SV2. En el caso de la TB‑A interacciona principalmente con la isoforma SV2C, previa glicosilación de esta7.
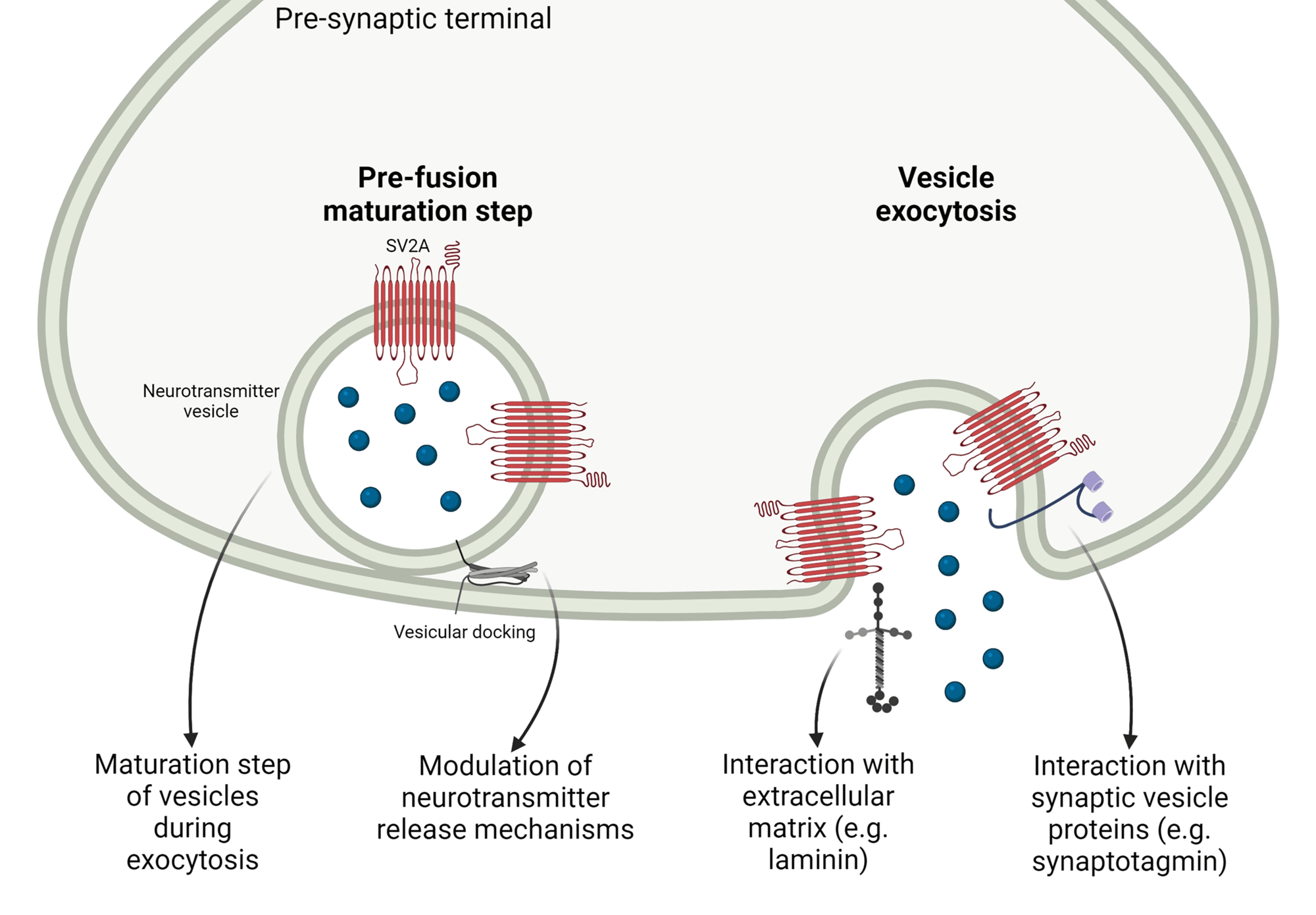
Se está de acuerdo en que la debilidad muscular se debe a la acción específica de la TB sobre el receptor de la acetilcolina; siendo la parte farmacológicamente activa la proteína de 150 kDa de peso molecular, de los que 100 kDa corresponden a la cadena pesada y 50 kDa a la cadena ligera, estando unidas ambas por un puente disulfuro. La cadena ligera escinde las proteínas SNARE (soluble N‑ethylmaleimide sensitive attachment protein receptor), que intervienen en el transporte de vesículas de acetilcolina y su acoplamiento a la membrana presináptica antes, impidiendo la liberación de acetilcolina en la hendidura sináptica8. Esto da como resultado una parálisis temporal y reversible de los músculos9‑11.
Una vez inyectada la TB, su efecto relajante comienza en dos a cinco días y se estima completo en 10‑12 días. Los músculos tratados alcanzan su máxima relajación en cinco o seis semanas y comienza a decaer este efecto en dos o tres meses12‑14.
La toxina al ser una proteína tiene capacidad inmunogénica y, en consecuencia, podría desarrollar resistencia, que puede ser primaria o secundaria. Esta respuesta inmunogénica interferiría tanto en el tiempo de comienzo del efecto como en la duración de este8,9. No obstante, cabe considerar que además de las posibles causas inmunogénicas, existen muchas otras, no inmunogénicas, que han de analizarse porque también tienen influencia sobre la duración del efecto de la toxina en la musculatura tratada15‑17.
Hay otros factores que dependen del médico que inyecta y de la manera en que lo hace. En ese sentido, ya se ha estudiado por diversos autores que las inyecciones intradérmicas de TB‑A en dosis altas son más inmunogénicas que las inyecciones intramusculares a la misma concentración18, lo que se ha relacionado con la presencia de numerosas células dendríticas en la dermis19‑21. Esto debería disuadir al médico de practicar el llamado mesobótox (mesoterapia intradérmica con TB)20.
Las causas inmunogénicas pueden prevenirse, pero no evitarse. En cambio, sí se puede actuar sobre las causas no inmunogénicas porque muchas son evitables. Nuestro objetivo es identificar las causas inmunogénicas y no inmunogénicas más comunes para actuar sobre ellas, posibilitando que aumente la eficacia y duración del efecto de la TB en los pacientes. De manera exhaustiva habrá que distinguir y analizar las causas achacables a la propia TB, a la idiosincrasia de paciente, las posibles causas externas o ambientales, así como la reconstitución e inyección de la TB.
Conceptos
Adentrarse en la complejidad que entraña este estudio no es posible sin tener claros los conceptos que siguen.
Pacientes que no responden primariamente
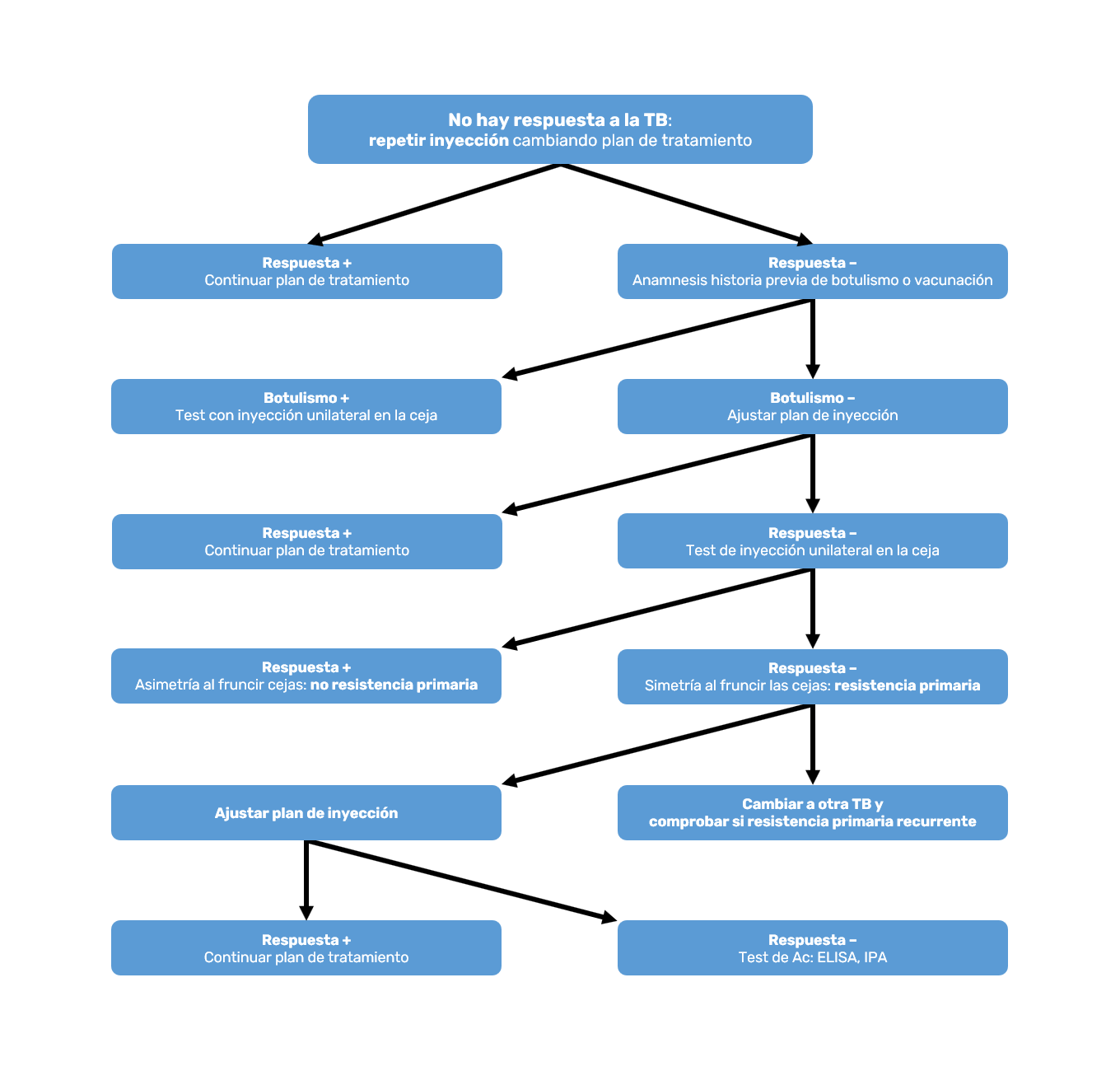
Son todos los pacientes que no obtienen beneficio o solo parcial en el tratamiento con TB, desde la primera inyección y siguientes, si es que se sigue intentando21. Sin embargo, tampoco queda claro que este concepto no se deba a una práctica errónea, bien por inyectar dosis bajas de TB o por no inyectar adecuadamente en los músculos apropiados22. En pacientes con distonías musculares diversas o cuadros de espasticidad se han encontrado patrones genéticos ligados a la presencia de anticuerpos (Ac), pero esto es difícilmente exportable a la población general, sin afecciones neurológicas, que pretende una mejoría estética.
La actuación ante un paciente que no responde primariamente puede ser la indicada en el algoritmo de la Figura 2.
Pacientes que no responden secundariamente
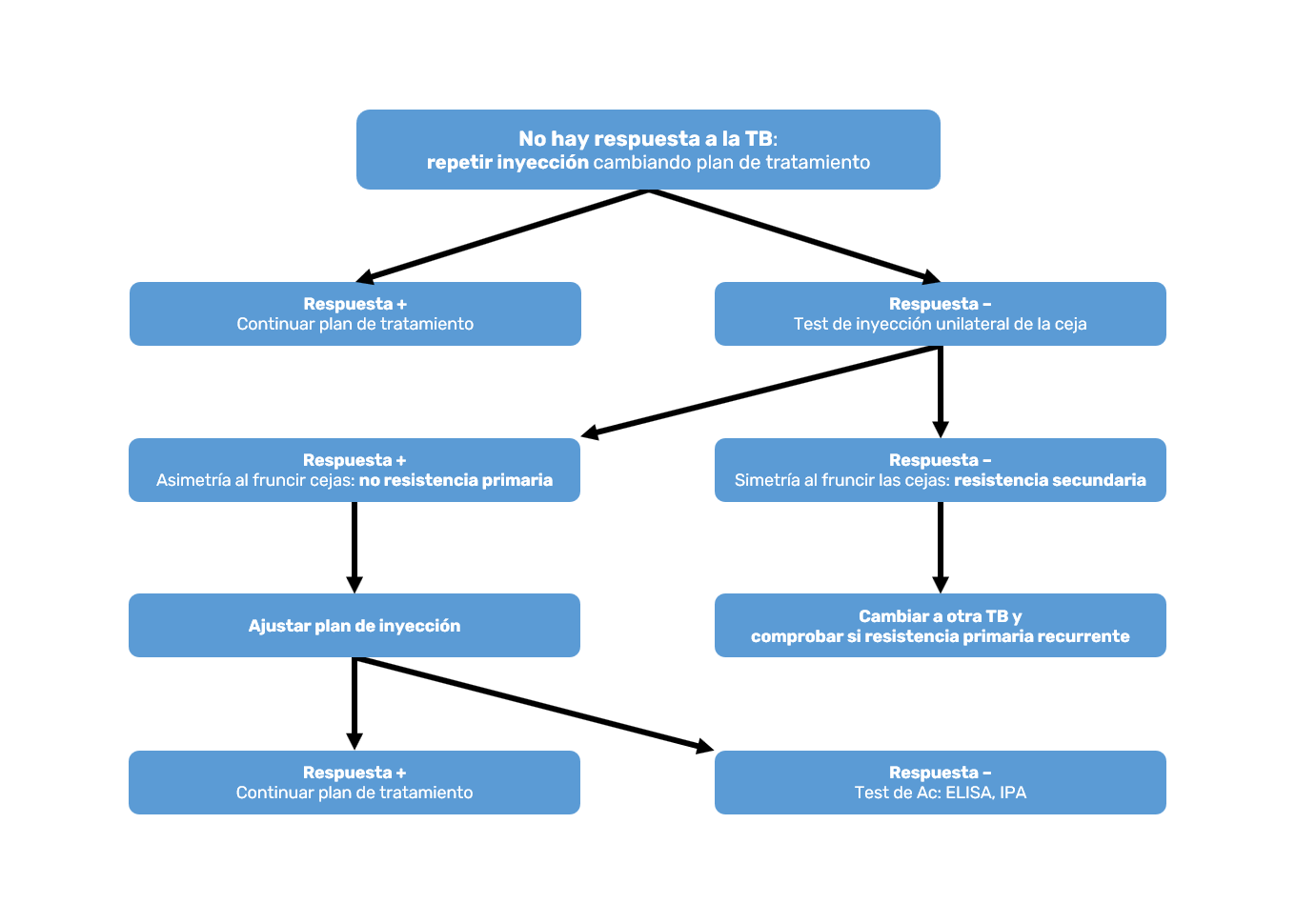
Inicialmente hay buena respuesta al tratamiento con TB, pero dejan de responder durante dos tratamientos seguidos. Al tratarse de una proteína siempre es posible que las inyecciones repetidas puedan inducir formación de Ac neutralizantes23. Conviene resaltar que la prevalencia de Ac neutralizantes, en el conjunto de tratamientos con TB, por motivos estéticos o neurológicos es muy baja (3,5%), habiendo pacientes que responden con presencia de Ac y pacientes que no responden, aunque no se detecten Ac en ellos25. Por otra parte, son coincidentes los estudios que señalan que la producción de Ac va ligada al empleo de dosis elevadas de TB, que suelen ser las que se utilizan en cuadros clínicos con espasticidad o distonía capaces de afectar músculos grandes en territorios extensos; nada que ver con las dosis empleadas en medicina estética8.
Para enfrentar esta posible situación es aconsejable seguir las pautas del correspondiente algoritmo (Figura 3).
Inmunogenicidad
Dentro de la búsqueda de Ac contra la TB, los denominados bioensayos son los únicos que han demostrado capacidad para distinguir entre Ac neutralizantes y no neutralizantes, siendo el ensayo de protección en ratones (Mouse Protection Assay, MPA) el patrón de referencia, aunque tiene el inconveniente de que muchos ratones no sobreviven a la prueba26. Esto ha hecho que se prefiera utilizar el ensayo en el hemidiafragma del ratón (Mouse Hemidiaphragm Assay, MHDA), que al tener mayor sensibilidad requiere menos animales, aunque a costa de más falsos negativos27. Los análisis de tipo estructural, como ELISA (Enzyme-Linked Immunosorbent Assay) e IPA (Immunoprecipitation Assay), aunque son altamente sensibles no distinguen entre los diversos Ac26,28.
Para evitar los inconvenientes de los análisis, se emplean las denominadas pruebas clínicas de inmunorresistencia. Una de ellas consiste en inyectar sobre el corrugador derecho 20 U de Ona o Incobotulinumtoxin A o 50 U de Abobotulinumtoxin A y valorar el fruncimiento de las cejas entre una y 3 semanas. Si el resultado es positivo, se induce parálisis del corrugador, produciéndose un fruncimiento asimétrico, descartando así a los pacientes que se suponen no respondedores25.
Sobre los pacientes que reciben dosis más elevadas de TB existen numerosos estudios, revisiones y metaanálisis que aportan datos sobre su empleo en indicaciones neurológicas y estéticas; pero hay que tomarlos con cierta prudencia, pues no siempre se agrupan por tratamientos concretos, frecuencia y unidades de aplicación29. Lo mismo puede decirse sobre otras aplicaciones habituales en medicina estética como en la hiperhidrosis axilar, en la que se emplean un alto número de unidades por sesión sin que prácticamente se hayan detectado Ac30.
Ahora bien, en todas las consideraciones previas o posteriores que se hagan ha de quedar claro que hay distintas neurotoxinas y que no son intercambiables entre sí31,32. Por ello, la determinación del contenido total de cada una no puede tomarse a la ligera debido a las proteínas acompañantes en ellas, como en caso de Abobotulinumtoxin A y Onabotulinumtoxin A10. Para poder establecer una comparativa, lo que debe analizarse es el contenido de neurotoxina como tal, es decir de la fracción de 150 kD, que es la parte activa. Sin embargo, en dependencia de la financiación de los estudios, los resultados son discordantes. Bien porque se emplean viales de mayor contenido, destinados a usos terapéuticos distintos que los utilizados en las correcciones estéticas o bien por no diferenciar entre tratamientos; se desconoce también si la toxina aprobada para estética, proviniendo del mismo fabricante que fabrica la de uso hospitalario, es exactamente la misma14, aunque inicialmente el número de serie de fabricación de Botox® y Vistabel® era el mismo, por citar un ejemplo.
En un reciente metaanálisis, en el que se han combinado indicaciones distintas de la TB, se informa que el 0,5% (27 pacientes) de una muestra de 5.876 tuvieron Ac neutralizantes al final del tratamiento. Sin embargo, en la evaluación final del estudio solo un 0,3% (16 pacientes) permaneció seropositivo24. Es destacable que de los 10 tratamientos realizados solo 2 eran estéticos, con la particularidad de que había pacientes que habían realizado más de 15 sesiones de tratamiento, lo que da una idea de la baja incidencia registrada.
Otro aspecto, relacionado con la comunicación de mayor número de reacciones inmunogénicas, podría deberse a que hay nuevas toxinas comercializadas, muchas procedentes del sudeste asiático33. En algunos estudios se ha comunicado que varias toxinas contienen impurezas de naturaleza proteica, lo que explicaría el aumento de tasas inmunogénicas de manera global; asimismo, asociado con el empleo cada vez mayor de la TB, tanto en indicaciones de ficha técnica como fuera de ella (off label). Por otra parte, no todo lo que se considera como neurotoxina es principio activo, lo que dificulta aún más, si cabe, la interpretación de resultados33,34.
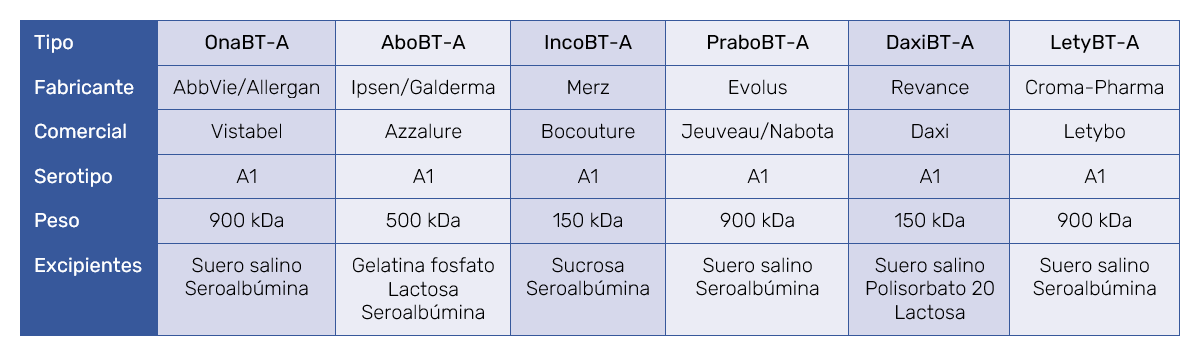
Tampoco se puede saber si el aumento de incidencia de la inmunogenicidad reside en el empleo de toxinas de origen dudoso, que no poseen el pertinente marcaje CE y son inyectadas por profesionales no médicos en centros estéticos que, obviamente, no disponen de la licencia sanitaria U.48. Las TB aprobadas por la FDA o con marcaje CE figuran en la Tabla I.
Es sabido que realizar numerosos tratamientos a la vez sobre un mismo paciente no parece una buena idea, aunque las indicaciones sean correctas. Si se suman las unidades empleadas en tratar en la misma sesión las arrugas del tercio superior, los m. maseteros si concurre bruxismo o la hiperhidrosis axilar, palmar o plantar nos estaremos aproximando a cantidades similares a las empleadas en tratar distonías y/o espasticidades en cuadros neurológicos. Como se ha visto, emplear mayores cantidades puede derivar en la aparición de inmunorresistencia28,29.
Por último, hay un hecho destacable como ofertar el tratamiento con TB por áreas separadas: arrugas glabelares, del frontal y de las patas de gallo. Esto induce a que el paciente realice un tratamiento por zona cada mes, en función de su disponibilidad económica. No hay datos publicados sobre si esta modalidad podría conducir a que los pacientes desarrollen inmunorresistencia debida a la frecuencia de inyección, aunque las dosis se apliquen de forma ajustada a cada zona. Eso sin mencionar la incorrección técnica de no considerar las expresiones como una exquisita interacción entre músculos agonistas y antagonistas.
Causas no inmunogénicas
Mas allá de las causas capaces de liberar Ac neutralizantes contra la TB, es preciso detenerse en el análisis de posibles causas ligadas a las diferentes toxinas presentes en el mercado, al propio paciente o al modo en que se realizan los tratamientos.
Inherentes a la propia toxina
Existe discrepancia entre las distintas potencias de las toxinas; sin embargo, no hay trabajos bien realizados para diferenciar claramente este aspecto. Nestor et al (2017), partiendo de la base que todas las TB‑A actúan de la misma manera, afirmaron que unas toxinas difieren de otras cuando se tiene en cuenta la asociación de la neurotoxina con los complejos proteicos, aunque no necesariamente se reflejaría en la práctica clínica35‑37. Además, hay que tener en cuenta el número de receptores neuromusculares, cuya distribución y densidad son variables según el género, la edad y la masa muscular; todos ellos son factores que obligan a ser exquisitos en la valoración de cada zona que quiera tratarse8,38. En ese sentido debe diferenciarse entre difusión y dispersión de la TB; mientras que la difusión se considera un fenómeno pasivo e independiente del lugar o la técnica de inyección, la dispersión es activa y depende del lugar y la profundidad de la inyección, la fuerza de extrusión que se ejerce al inyectar, del volumen inyectado y del calibre de la aguja empleada22,39. El término migración debe reservarse para indicar el efecto de la TB más allá de la localización original y del músculo objetivo del tratamiento. Un clásico ejemplo es la caída del párpado superior secundaria a la migración de la TB inyectada, supuestamente en un m. corrugador, que acaba afectando al m. elevador del párpado superior.
Respecto de la edad, varias TB están aprobadas para emplearse en personas por debajo de los 65 años, aunque este tope no se respete; pero hay que tener en cuenta que la fuerza y la masa muscular decae con la edad. En muchos trabajos se ha postulado una mayor duración del efecto relajante de una marca comercial de toxina sobre otra, aunque no se ha establecido hasta la fecha ninguna escala capaz de validar esos postulados sin dejar lugar a dudas40,41.
Inherentes al paciente
Factores como el sexo del paciente puede influir en la duración, y de hecho influye, en general dura más a las mujeres que a los hombres. No obstante, hay que señalar que los hombres, que suelen poseer músculos más desarrollados que las mujeres pueden quedar infratratados si el número de unidades de TB aplicadas no aumenta proporcionalmente al grado de desarrollo muscular o al número más elevado de uniones neuromusculares presentes en los músculos más desarrollados. De igual manera sucede con los pacientes más jóvenes, ya que también precisan más unidades de TB porque sus músculos suelen ser más potentes y son accionados con más frecuencia16.
En un estudio ya clásico, De Maio (2008) observó que los denominados pacientes hipertónicos, aquellos cuya gesticulación facial es constante y no ligada a la expresión emocional, no eran los mejores candidatos para ser tratados con TB, ya que la duración era notablemente menor (solo 2 o 3 meses) que en los pacientes hipercinéticos cuya mímica facial se corresponde con la expresión de emociones42.
También se ha informado que las situaciones de estrés en la vida del paciente inducen una menor duración del efecto de la TB por una mayor contracción muscular durante más tiempo43.
Factores externos
Entre los factores que podrían influir en el comportamiento de la TB uno de ellos es la temperatura ambiental. Excesivo calor o frío cuando el paciente sale de la consulta con el tratamiento recién hecho pueden acortar el tiempo de duración, aunque este dato es difícil de documentar, ya que el tiempo de exposición habría de ser lo suficientemente duradero para poder influir (exposición solar prolongada). Obviamente, el calor y el frío influyen de forma opuesta en la termorregulación y, en definitiva, no queda claro si la vasoconstricción o vasodilatación, según se trate, más la influencia local de mediadores químicos pueden tener un papel determinante. Desde luego, quedaría a merced de una investigación exquisita dilucidar la parte que a cada uno le pudiera corresponder. De momento, se dispone de información sobre el beneficio que la TB aporta al fenómeno de Raynaud, involucrando la acción del óxido nítrico sobre el mecanismo vasodilatador44‑46.
A favor del empleo de la TB en climas más calurosos, y su posible mayor duración, hace que algunos autores se decanten a favor de emplear preparaciones que solo contienen la TB de 150 kD, sin proteínas complejantes. No obstante, la evidencia que se tiene es insuficiente todavía como para generalizar esta recomendación47.
Reconstitución de la toxina botulínica
Se ha relacionado la forma de reconstituir la toxina por parte del médico como la mejor manera de preservar la potencia y prolongar la duración del efecto. En primer lugar, debe evitarse introducir el suero salino con mucha presión en el vial, o agitarlo enérgicamente, así como realizar varias aspiraciones con reinyección dentro del propio vial, o utilizar una aguja fina para la manipulación o reconstitución de la TB. Mientras un estudio concluye que una mayor o menor agitación del vial no modifica el resultado ni acorta el tiempo de duración del efecto48, otro estudio más reciente informa que las manipulaciones bruscas provocan una pérdida de eficacia de la TB que puede llegar a ser hasta del 42%, además de iniciar su efecto relajante de forma más tardía. No obstante, este estudio se ha realizado en ratones y no en personas22.
Creemos que las maniobras bruscas no deberían practicarse; es aconsejable actuar sin prisa, dejar que el suero resbale por una de las paredes del vial, realizar movimientos suaves de rotación sobre el vial sin calentarlo con la mano, esperar un tiempo prudencial para que se produzca la adecuada dilución de la TB en el suero, extraer la toxina sin aspirar bruscamente, mejor con aguja de 21G. Inmediatamente proceder a la inyección lenta en el paciente a través de una aguja 30G. En caso de no utilizar la TB ya reconstituida de forma inmediata, por anulación o retraso del paciente al que se ha de administrar, es obligatorio que permanezca en el vial y sea colocada nuevamente en el frigorífico manteniéndola a temperatura de 4 a 8° C para detener su posible degradación12.
Otro aspecto por cuidar es referente a purgar la jeringa para eliminar la burbuja de aire que se forma en el interior de esta al aspirar la toxina. Es recomendable extraerla sin golpear ni agitar la jeringa, simplemente dar pequeños toques con la yema del dedo índice sobre la jeringa en posición vertical con la aguja hacia arriba, moviendo ligeramente el émbolo35,36.
Inherentes a la técnica
La técnica de inyección es uno más de los factores que entran en juego a la hora de valorar la eficacia y duración de la TB. Aspectos como la velocidad de propagación o dispersión de la TB desde el punto de inyección han de tenerse en cuenta. Es importante saber que la velocidad va ligada a la presión ejercida sobre el émbolo de la jeringa, tipo de jeringa y diámetro de la aguja35,36. Obviamente influirá el volumen inyectado, la rapidez de la inyección o la inclinación de la aguja sobre la piel. Todos los mencionados podrán influir en la cantidad efectiva de TB que alcanza los receptores intramusculares16.
Enfriar o no enfriar la piel antes de inyectar puede que no sea la cuestión. Desde hace tiempo se ha propuesto que la aplicación de frío local reduce la molestia de la inyección49, aunque aplicar excesivo frío hace que el paciente también se queje del dolor inducido por este. Esto también debe evitarse, ya que el frío intenso puede trasmitirse al músculo objeto de tratamiento, reduciendo la absorción de la toxina desde el punto de inyección y, por lo tanto, reduciendo posteriormente la duración del efecto50. Sin embargo, el empleo de cloruro de etilo tiene la particularidad de aplicarse durante unos breves segundos y la duración de su efecto es muy limitada en el tiempo, así como la posible influencia en limitar la absorción de TB por el músculo51. Tampoco se ha comprobado que hubiera reducción del efecto de la TB cuando se han aplicado cremas anestésicas, habida cuenta que algunos de los anestésicos empleados en ellas poseen efecto vasodilatador52; el problema sería la limpieza incorrecta y que pudiera entrar con la aguja en el punto de inyección provocando irritación puntual.
Si se prescinde del frío, para que el paciente tenga mejor confort, una buena técnica es traer la piel a la aguja y no la aguja a la piel, al tiempo que se acaricia o presiona cerca del punto de inyección a fin de distraer la atención sobre el pinchazo53. Cambiar la aguja cada 6 o 10 pinchazos también es una buena opción para disminuir el dolor.
La posición del bisel de la aguja debe contemplarse al inyectar; si se deja hacia abajo es más factible que la TB se deposite en el músculo o más próxima a éste que si coloca hacia arriba, lo que enviaría el producto hacia la piel o el tejido subcutáneo. Este detalle es muy importante, porque la profundidad determinará si la inyección es intramuscular, lo que conlleva un efecto paralizante o si es subcutánea, que solo posee un efecto relajante. La inyección demasiado profunda sobre músculos planos (orbicular, frontal) puede provocar que el depósito de TB se realice en posición retromuscular y su efecto sería similar al de una inyección subcutánea.
Obviamente, la inyección de la TB centrada en el espesor del músculo obtiene mejor resultado en orden de eficacia, como consecuencia del mayor número de uniones neuromusculares presentes disminuyendo el número de unidades de TB necesarias, a diferencia de la inyección en zonas periféricas cuya menor efectividad se relaciona con menos uniones neuromusculares. No obstante, lo que cuenta es inyectar la dosis adecuada y efectiva en el músculo que se está tratando; muchas unidades en un solo punto pueden conllevar una difusión a territorios contiguos, con posibilidad de tener efectos secundarios, como una posible ptosis palpebral54. Es preferible distribuir las inyecciones con menores volúmenes y mayor concentración, especialmente en la zona frontal, porque alcanzarán más receptores neuromusculares, lo que se traducirá en un comienzo más rápido de la acción y mayor duración del efecto37.
Realizado el pinchazo es importante no embolizar, la TB no debe inyectarse de forma rápida (en forma de bolo). A mayor presión el depósito que se hace cambia de forma, pasando de circular a elíptica, siendo el diámetro mayor de la elipse más largo cuanto mayor es la rapidez de la inyección; es similar a lo que sucede con agujas de muy bajo calibre53.
Terminado el tratamiento, es conveniente que la limpieza de la zona la haga el propio médico. Si se delega, el personal auxiliar debe proceder con cuidado de no presionar o masajear las áreas tratadas, lo que podría distribuir la TB en músculos cercanos provocando efectos no deseados. Igualmente, hay que indicar al paciente que gesticule inmediatamente después del tratamiento, lo que ayudará a una mejor difusión y fijación de la fracción activa de la TB, alcanzando mayor número de terminales neuromusculares y contribuyendo a un mayor efecto relajante55.
Documentación iconográfica
Las prisas no son buenas. Es de suma importancia obtener fotografías antes de cada tratamiento, aunque ya se haya tratado al paciente con anterioridad. Las fotografías deben tomarse en reposo y en movimiento, instando al paciente a gesticular para obtener información fidedigna de la dinámica facial. Muchas veces es la fotografía el elemento adecuado para dilucidar sobre la duración del efecto del tratamiento. Cuando el paciente dice que el efecto esta vez le ha durado menos, conviene revisar su historial en el que constará la fecha del tratamiento y el esquema de distribución de las unidades inyectadas en cada punto. Se procederá a tomar nuevas fotografías, estáticas y dinámicas, igual que antes de ser tratado. Es la única forma de detectar cambios sutiles, tanto por el médico como por el propio paciente56.
Además, la fotografía o el vídeo en gesticulación dinámica pueden poner de manifiesto asimetrías no valoradas al primer golpe de vista, lo que es conveniente señalar al paciente, que muchas veces no es consciente de ellas, para evitar posibles reclamaciones posteriores al tratamiento57.
Conclusiones
El buen resultado del tratamiento estético con TB depende de que se tengan en cuenta las causas inmunogénicas y no inmunogénicas. Cualquiera de ellas puede producir un menor efecto relajante del esperado o un tiempo de relajación más corto.
Las causas no inmunogénicas se pueden minimizar reconstituyendo correctamente la TB, depurando la técnica de inyección y aplicando la dosis eficaz para conseguir el efecto deseado, teniendo en cuenta las interacciones con los músculos vecinos, ya que también se depende de los músculos no tratados para una buena respuesta.
El paciente debe ser bien estudiado estática y dinámicamente con ayuda de la fotografía y/o del vídeo para documentar los cambios de antes y después del tratamiento.
No es conveniente utilizar dosis elevadas en el tratamiento con TB buscando que la duración sea mayor ni repetir los tratamientos en intervalos breves para satisfacer al paciente. Tampoco conviene realizar muchos tratamientos a la vez en el mismo paciente porque el aumento de dosis favorecerá la aparición de Ac neutralizantes propiciando el fracaso del tratamiento. Ser meticulosos en el tratamiento y seguir una metódica hará que los resultados sean repetibles y si no fuesen los esperados, detectar donde puede estar el error.
El uso de productos con menor carga proteica inmunizante puede reducir la respuesta inmunogénica. Pero también hay que abstenerse de emplear toxinas de origen dudoso.
La TB es una excelente herramienta en nuestra práctica médica. Cuidar los detalles es cuidar a nuestros pacientes.
Declaración
Los autores declaran no tener conflicto de intereses con ninguno de los productos mencionados.
Bibliografía
- ISAPS. Aesthetic/Cosmetic procedures performed in 2020. https://www.isaps.org
- Aesthetic Plastic Surgery National Databank. STATISTICS 2020‑2021. The Aesthetic Society Web site. https://www.surgery.org
- Dong M, Yeh F, Tepp WH, Dean C, Johnson EA, Janz R, Chapman ER. SV2 is the protein receptor for botulinum neurotoxin A. Science. 2006 Apr 28;312(5773):592‑6. https://doi.org/10.1126/science.1123654
- Rossi R, Arjmand S, Bærentzen SL, Gjedde A, Landau AM. Synaptic Vesicle Glycoprotein 2A: Features and Functions. Front Neurosci. 2022 Apr 28;16:864514. https://doi.org/10.3389/fnins.2022.864514
- Colasante C, Rossetto O, Morbiato L, Pirazzini M, Molgó J, Montecucco C. Botulinum neurotoxin type A is internalized and translocated from small synaptic vesicles at the neuromuscular junction. Mol Neurobiol. 2013 Aug;48(1):120‑7. https://doi.org/10.1007/s12035-013‑8423‑9
- Rummel A. Double receptor anchorage of botulinum neurotoxins accounts for their exquisite neurospecificity. Curr Top Microbiol Immunol. 2013;364:61‑90. https://doi.org/10.1007/978-3‑642‑33570‑9_4
- Yao G, Zhang S, Mahrhold S, Lam KH, Stern D, Bagramyan K, Perry K, Kalkum M, Rummel A, Dong M, Jin R. N‑linked glycosylation of SV2 is required for binding and uptake of botulinum neurotoxin A. Nat Struct Mol Biol. 2016 Jul;23(7):656‑62. https://doi.org/10.1038/nsmb.3245
- Bellows S, Jankovic J. Immunogenicity Associated with Botulinum Toxin Treatment. Toxins (Basel). 2019 Aug 26;11(9):491. https://doi.org/10.3390/toxins11090491
- Eisele KH, Fink K, Vey M, Taylor HV. Studies on the dissociation of botulinum neurotoxin type A complexes. Toxicon. 2011 Mar 15;57(4):555‑65. https://doi.org/10.1016/j.toxicon.2010.12.019
- Frevert J. Pharmaceutical, biological, and clinical properties of botulinum neurotoxin type A products. Drugs R D. 2015 Mar;15(1):1‑9. https://doi.org/10.1007/s40268-014‑0077‑1
- Gardner AP, Barbieri JT, Pellett S. How Botulinum Neurotoxin Light Chain A1 Maintains Stable Association with the Intracellular Neuronal Plasma Membrane. Toxins (Basel). 2022 Nov 22;14(12):814. https://doi.org/10.3390/toxins14120814
- Alcolea JM. Actualización sobre aplicaciones de la toxina botulínica en estética facial. Cir.plást.iberolatinoam. 2011;37(1):81‑90. https://doi.org/10.4321/S0376-78922011000100012
- Eleopra R, Rinaldo S, Montecucco C, Rossetto O, Devigili G. Clinical duration of action of different botulinum toxin types in humans. Toxicon. 2020 May;179:84‑91. https://doi.org/10.1016/j.toxicon.2020.02.020
- Field M, Splevins A, Picaut P, van der Schans M, Langenberg J, Noort D, Snyder D, Foster K. AbobotulinumtoxinA (Dysport®), OnabotulinumtoxinA (Botox®), and IncobotulinumtoxinA (Xeomin®) Neurotoxin Content and Potential Implications for Duration of Response in Patients. Toxins (Basel). 2018 Dec 13;10(12):535. https://doi.org/10.3390/toxins10120535
- Brin MF, James C, Maltman J. Botulinum toxin type A products are not interchangeable: a review of the evidence. Biologics. 2014 Oct 6;8:227‑41. https://doi.org/10.2147/BTT.S65603
- Dover JS, Monheit G, Greener M, Pickett A. Botulinum Toxin in Aesthetic Medicine: Myths and Realities. Dermatol Surg. 2018 Feb;44(2):249‑260. https://doi.org/10.1097/DSS.0000000000001277
- Lacroix-Desmazes S, Mouly S, Popoff MR, Colosimo C. Systematic analysis of botulinum neurotoxin type A immunogenicity in clinical studies. Basal Ganglia 2017; 9:12‑17. https://doi.org/10.1016/j.baga.2017.06.001
- Wanitphakdeedecha R, Yan C, Apinuntham C, Rojanavanich V, Cembrano KAG, Eimpunth S, Manuskiatti W. Intradermal Micro-Dosing of AbobotulinumtoxinA for Face-Lifting: How Long Does It Last? Dermatol Ther (Heidelb). 2020 Aug;10(4):779‑789. https://doi.org/10.1007/s13555-020‑00414‑7
- Sharma SK, Singh BR. Enhancement of the endopeptidase activity of purified botulinum neurotoxins A and E by an isolated component of the native neurotoxin associated proteins. Biochemistry. 2004 Apr 27;43(16):4791‑8. https://doi.org/10.1021/bi0355544
- Malissen B, Tamoutounour S, Henri S. The origins and functions of dendritic cells and macrophages in the skin. Nat Rev Immunol. 2014 Jun;14(6):417‑28. https://doi.org/10.1038/nri3683
- Pirazzini M, Montecucco C, Rossetto O. Toxicology and pharmacology of botulinum and tetanus neurotoxins: an update. Arch Toxicol. 2022 Jun;96(6):1521‑1539. https://doi.org/10.1007/s00204-022‑03271‑9
- Dressler D, Bigalke H. Reconstituting botulinum toxin drugs: shaking, stirring or what? J Neural Transm (Vienna). 2016 May;123(5):523‑5. https://doi.org/10.1007/s00702-016‑1538‑1
- Ramirez-Castaneda J, Jankovic J. Long-term efficacy and safety of botulinum toxin injections in dystonia. Toxins (Basel). 2013 Feb 4;5(2):249‑66. https://doi.org/10.3390/toxins5020249
- Jankovic J, Carruthers J, Naumann M, Ogilvie P, Boodhoo T, Attar M, Gupta S, Singh R, Soliman J, Yushmanova I, Brin MF, Shen J. Neutralizing Antibody Formation with OnabotulinumtoxinA (BOTOX®) Treatment from Global Registration Studies across Multiple Indications: A Meta-Analysis. Toxins (Basel). 2023 May 17;15(5):342. https://doi.org/10.3390/toxins15050342
- Fabbri M, Leodori G, Fernandes RM, Bhidayasiri R, Marti MJ, Colosimo C, Ferreira JJ. Neutralizing Antibody and Botulinum Toxin Therapy: A Systematic Review and Meta-analysis. Neurotox Res. 2016 Jan;29(1):105‑17. https://doi.org/10.1007/s12640-015‑9565‑5
- Hanna PA, Jankovic J, Vincent A. Comparison of mouse bioassay and immunoprecipitation assay for botulinum toxin antibodies. J Neurol Neurosurg Psychiatry. 1999 May;66(5):612‑6. https://doi.org/10.1136/jnnp.66.5.612
- Lange O, Bigalke H, Dengler R, Wegner F, deGroot M, Wohlfarth K. Neutralizing antibodies and secondary therapy failure after treatment with botulinum toxin type A: much ado about nothing? Clin Neuropharmacol. 2009 Jul‑Aug;32(4):213‑8. https://doi.org/10.1097/WNF.0b013e3181914d0a
- Srinoulprasert Y, Kantaviro W, Nokdhes YN, Patthamalai P, Dowdon L, Chawengkiattikul R, Wanitphakdeedecha R. Development of inhibition ELISA to detect antibody-induced failure of botulinum toxin a therapy in cosmetic indications. J Immunol Methods. 2019 Oct;473:112635. https://doi.org/10.1016/j.jim.2019.112635
- Naumann M, Jankovic J. Safety of botulinum toxin type A: a systematic review and meta-analysis. Curr Med Res Opin. 2004 Jul;20(7):981‑90. https://doi.org/10.1185/030079904125003962
- Glaser DA, Pariser DM, Hebert AA, Landells I, Somogyi C, Weng E, Brin MF, Beddingfield F. A Prospective, Nonrandomized, Open-Label Study of the Efficacy and Safety of OnabotulinumtoxinA in Adolescents with Primary Axillary Hyperhidrosis. Pediatr Dermatol. 2015 Sep‑Oct;32(5):609‑17. https://doi.org/10.1111/pde.12620
- Hanna E, Pon K. Updates on Botulinum Neurotoxins in Dermatology. Am J Clin Dermatol. 2020 Apr;21(2):157‑162. https://doi.org/10.1007/s40257-019‑00482‑2
- Kerscher M, Roll S, Becker A, Wigger-Alberti W. Comparison of the spread of three botulinum toxin type A preparations. Arch Dermatol Res. 2012 Mar;304(2):155‑61. https://doi.org/10.1007/s00403-011‑1179‑z
- Park JY, Corduff N, Frevert J, Wanitphakdeedecha R, Chao YYY. Immunogenicity Associated with Aesthetic Botulinumtoxin A: A Survey of Asia-Pacific Physicians' Experiences and Recommendations. Plast Reconstr Surg Glob Open. 2022 Apr 18;10(4):e4217. https://doi.org/10.1097/GOX.0000000000004217
- Frevert J, Ahn KY, Park MY, Sunga O. Comparison of botulinum neurotoxin type A formulations in Asia. Clin Cosmet Investig Dermatol. 2018 Jul 5;11:327‑331. https://doi.org/10.2147/CCID.S160723
- Nestor M, Ablon G, Pickett A. Key Parameters for the Use of AbobotulinumtoxinA in Aesthetics: Onset and Duration. Aesthet Surg J. 2017 May 1;37(suppl_1):S20‑S31. https://doi.org/10.1093/asj/sjw282
- Nestor MS, Kleinfelder RE, Pickett A. The Use of Botulinum Neurotoxin Type A in Aesthetics: Key Clinical Postulates. Dermatol Surg. 2017 Dec;43 Suppl 3:S344‑S362. https://doi.org/10.1097/DSS.0000000000001412
- Nestor MS, Arnold D, Fischer DL. The mechanisms of action and use of botulinum neurotoxin type A in aesthetics: Key Clinical Postulates II. J Cosmet Dermatol. 2020 Nov;19(11):2785‑2804. https://doi.org/10.1111/jocd.13702
- Ho WWS, Albrecht P, Calderon PE, Corduff N, Loh D, Martin MU, Park JY, Suseno LS, Tseng FW, Vachiramon V, Wanitphakdeedecha R, Won CH, Yu JNT, Dingley M. Emerging Trends in Botulinum Neurotoxin A Resistance: An International Multidisciplinary Review and Consensus. Plast Reconstr Surg Glob Open. 2022 Jun 20;10(6):e4407. https://doi.org/10.1097/GOX.0000000000004407
- Hsu TS, Dover JS, Arndt KA. Effect of volume and concentration on the diffusion of botulinum exotoxin A. Arch Dermatol. 2004 Nov;140(11):1351‑4. https://doi.org/10.1001/archderm.140.11.1351
- Dressler D, Pan L, Adib Saberi F. Antibody-induced failure of botulinum toxin therapy: re‑start with low-antigenicity drugs offers a new treatment opportunity. J Neural Transm (Vienna). 2018 Oct;125(10):1481‑1486. https://doi.org/10.1007/s00702-018‑1911‑3
- Shome D, Kapoor R, Khare S. Two different types of botulinum toxins: Is there a difference in efficacy and longevity? J Cosmet Dermatol. 2019 Dec;18(6):1635‑1641. https://doi.org/10.1111/jocd.12949
- De Maio M, Ofenböck I, Narvaes C. Toxina botulínica: relación entre tipo de paciente y duración del efecto. Cir.plást.iberolatinoam. 2008;34(1):19‑26. https://doi.org/10.4321/S0376-78922008000100004
- Shtefan V, Fletcher J, Duclos OA. Causes of Botulinum Toxin Treatment Failure. Clin Cosmet Investig Dermatol. 2022 Jun 7;15:1045‑1049. https://doi.org/10.2147/CCID.S363321
- Lewandowski M, Świerczewska Z, Barańska-Rybak W. Off‑Label Use of Botulinum Toxin in Dermatology-Current State of the Art. Molecules. 2022 May 13;27(10):3143. https://doi.org/10.3390/molecules27103143
- Naik PP. Utilities of Botulinum Toxins in Dermatology and Cosmetology. Clin Cosmet Investig Dermatol. 2021 Sep 21;14:1319‑1330. https://doi.org/10.2147/CCID.S332247
- Du W, Zhou M, Zhang C, Sun Q. The efficacy of botulinum toxin A in the treatment of Raynaud's phenomenon in systemic sclerosis: A randomized self-controlled trial. Dermatol Ther. 2022 Jul;35(7):e15529. https://doi.org/10.1111/dth.15529
- Prager W. Differential characteristics of incobotulinumtoxinA and its use in the management of glabellar frown lines. Clin Pharmacol. 2013;5:39‑52. https://doi.org/10.2147/CPAA.S37582
- Kazim NA, Black EH. Botox: shaken, not stirred. Ophthalmic Plast Reconstr Surg. 2008 Jan‑Feb;24(1):10‑2. https://doi.org/10.1097/IOP.0b013e3181607475
- Beer K, Cohen J, Carruthers A. Cosmetic uses of botulinum toxin A. In: Ward A, Barnes M, editors. Clinical Uses of Botulinum Toxins. Cambridge, United Kingdom: Cambridge University Press; 2007; pp. 328‑48. https://doi.org/10.1017/CBO9780511544842.015
- Hallett M. Explanation of timing of botulinum neurotoxin effects, onset and duration, and clinical ways of influencing them. Toxicon. 2015 Dec 1;107(Pt A):64‑7. https://doi.org/10.1016/j.toxicon.2015.07.013
- Irkoren S, Ozkan HS, Karaca H. A Clinical Comparison of EMLA Cream and Ethyl Chloride Spray Application for Pain Relief of Forehead Botulinum Toxin Injection. Ann Plast Surg. 2015 Sep;75(3):272‑4. https://doi.org/10.1097/SAP.0000000000000121
- Sami MS, Soparkar CN, Patrinely JR, Hollier LM, Hollier LH. Efficacy of botulinum toxin type a after topical anesthesia. Ophthalmic Plast Reconstr Surg. 2006 Nov‑Dec;22(6):448‑52. https://doi.org/10.1097/01.iop.0000248989.33572.3c
- García-Monforte F, Castaño P. Toxina botulínica tipo A. Uso en medicina estética. En: Tresguerres JAF. Medicina Estética y Antienvejecimiento. Editorial Panamericana. 2ª edición. 2018. Madrid. págs. 303‑318.
- de Sanctis Pecora C, Pinheiro MVB, Ventura Ferreira K, Jacobino de Barros Nunes G, Miot HA. The One21 Technique: An Individualized Treatment for Glabellar Lines Based on Clinical and Anatomical Landmarks. Clin Cosmet Investig Dermatol. 2021 Feb 2;14:97‑105. https://doi.org/10.2147/CCID.S281901
- Abbasi NR, Durfee MA, Petrell K, Dover JS, Arndt KA. A small study of the relationship between abobotulinum toxin A concentration and forehead wrinkle reduction. Arch Dermatol. 2012 Jan;148(1):119‑21. https://doi.org/10.1001/archdermatol.2011.611
- García-Monforte F. Marcación de los puntos de inyección con toxina botulínica en el tercio superior de la cara. Medicina Estética. 2020;65(4):29‑33. https://doi.org/10.48158/MedicinaEstetica.065.04
- Alcolea JM, Trelles MA. Actualización sobre aplicaciones en estética de la toxina botulínica en el tercio inferior de la cara. Alcolea JM. Cir.plást.iberolatinoam. 2011;37(2):179‑190. https://doi.org/10.4321/S0376-78922011000200013


