Tratamiento con toxina botulínica
en pacientes oncológicos
Introducción
El cáncer es una de las principales causas de morbimortalidad en el mundo, cuyo tratamiento debe ser abordado desde el punto de vista biológico, psicológico y sociológico1.
La imagen corporal del paciente oncológico se ve claramente afectada, tanto por la propia enfermedad como por la cirugía y los tratamientos adyuvantes. El tratamiento con radioterapia frecuentemente deja secuelas, tales que asimetrías, dolor, alopecia y/o radiodermitis. La quimioterapia, en muchas ocasiones, cursa con cambios en el peso corporal3‑5.
La medicina estética dispone de tratamientos encaminados a mejorar la calidad de vida del paciente oncológico. Entre todos ellos destaca la toxina botulínica A (TBA), debido a nuevas aplicaciones clínicas que pueden beneficiarse de su uso, así como nuevos efectos descritos a nivel nociceptivo, antiinflamatorio y postquirúrgico6.
El objetivo de esta revisión es investigar el perfil de seguridad de la TBA en el paciente oncológico y su utilidad en la medicina estética.
Material y método
Para alcanzar el objetivo propuesto se ha realizado una búsqueda en las siguientes bases de datos: PubMed, Cochran Library, Google Académico, SciELO, ScienceDirect y UpToDate. La búsqueda se realizó desde enero de 2002 hasta junio de 2022, utilizando palabras clave de Medical Subjet Headings (MeSH): botulinum toxin, cancer, neuropathic pain, postsurgical pain, raditoherapy, chemotherapy.
Se consideraron como principales criterios de inclusión que fueran trabajos publicados entre 2002 y 2022 y que estuvieran escritos en inglés o español. La limitación de la búsqueda se realizó en base a los siguientes criterios de exclusión: estudios publicados antes del año 2002; otros idiomas; estudios duplicados y estudios cuyo contenido no guardara relación con el objetivo previsto.
Resultados
De los 58 artículos iniciales, tras aplicar los criterios mencionados, se consideraron válidos 24 artículos, se incluyeron ensayos controlados aleatorios, estudios observacionales e informes de casos. Se rescataron dos artículos adicionales al revisar las referencias de los artículos seleccionados. Los artículos de revisión y metaanálisis encontrados solo se tuvieron en cuenta para la discusión.
La característica que mejor define al paciente oncológico es la fragilidad2,5. En la bibliografía revisada, los efectos adversos referidos en tratamientos realizados en pacientes oncológicos con TBA son mínimos y no difieren, en general, de los encontrados en un paciente sano. La TBA es un tratamiento efectivo con bajo riesgo de interacciones farmacológicas4,7,8.
Discusión
El cáncer es una enfermedad de alta prevalencia; los pacientes son cada vez más jóvenes y los avances en el tratamiento han dado lugar a una enfermedad que, en muchas ocasiones, se hace crónica. De esta forma, están ganando una gran importancia los tratamientos enfocados a mejorar la calidad de vida de estos pacientes.
La TBA es actualmente un fármaco en auge, constituyendo una estrategia de tratamiento segura y poderosa en múltiples trastornos del movimiento hipercinético. Conforme se conocen mejor los resultados y su farmacocinética se descubren nuevas aplicaciones y beneficios gracias a su versatilidad.
A la hora de buscar evidencia científica que respalde su uso, así como los beneficios y su superioridad frente a pautas de tratamiento ya establecidas, se encuentran muchas limitaciones en lo que al paciente oncológico se refiere. Sin embargo, son muchos los estudios que avalan el uso de TBA para el tratamiento del dolor nociceptivo y postquirúrgico6‑8. El uso de dosis bajas TBA para el tratamiento del dolor postquirúrgico moderado a severo ha demostrado su efectividad, con dos ventajas importantes; en primer lugar, los efectos de la inyección de la neurotoxina dura entre tres y seis meses y, en segundo lugar, los efectos secundarios de la TBA son menores en comparación con los analgésicos potentes y exhibe un mejor perfil de seguridad9,10.
La inyección de TBA en las glándulas parótidas o submaxilares reduce los síntomas de la sialorrea secundaria a la lesión glandular postirradiación; de igual manera alivia la hiperhidrosis gustativa resultante de la cirugía parotídea y oral en pacientes con cáncer.
Otras indicaciones son la mejora de la movilidad articular postquirúrgica en tumores de cabeza y cuello, y la buena respuesta de las contracturas capsulares tras la reconstrucción mamaria (Figura 1). Existen estudios que revelan que la TBA se puede combinar de forma segura con la radioquimioterapia11‑14.
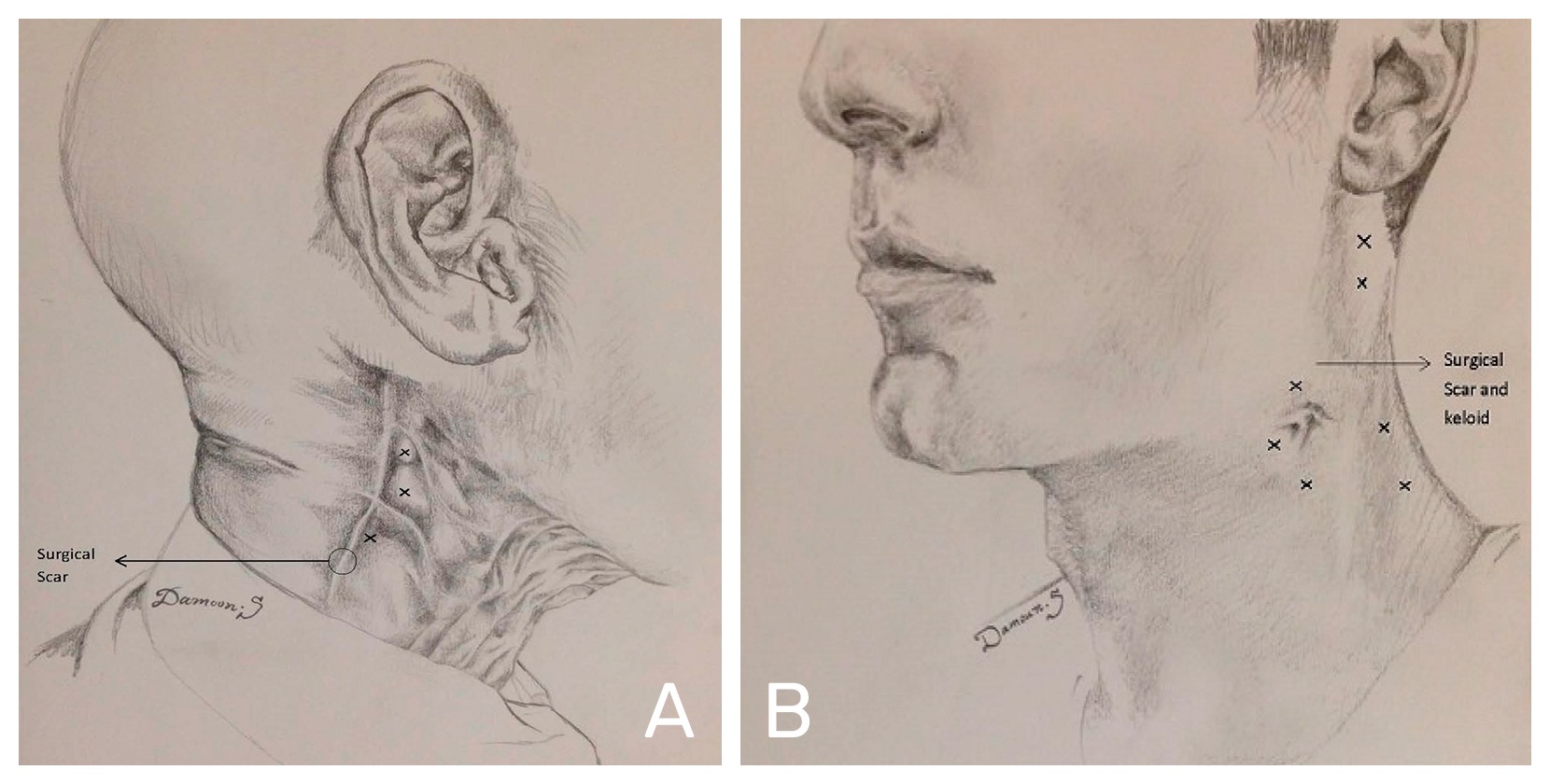
La TBA juega un papel fundamental en la corrección de asimetrías resultantes de secuelas como la parálisis facial, consiguiendo mejorías tanto estéticas como funcionales15. Es destacable que, incluso después de terminarse el efecto activo del tratamiento TBA, el efecto estético continúa. Una ventaja adicional a la terapia correctiva con este procedimiento es que la disminución temporal de la fuerza en el lado sano, potencia las maniobras de compensación contralaterales. Las inyecciones de TBA pueden inducir cambios inconscientes endógenos en el movimiento muscular y, por lo tanto, en el estado de ánimo de los pacientes, que culmina en menos ira, miedo y tristeza según la teoría de la retroalimentación facial10,16.
Con el empleo de la TBA se ha observado que presenta actividad sobre la regulación de la actividad fibroblástica y su ciclo celular, contrarrestando la expresión alterada de factores de crecimiento y de los genes implicados en la génesis de queloides y cicatrices, previniendo la diferenciación de fibroblastos a miofibroblastos, lo que disminuye la tensión tisular en la que asientan17,18. No obstante, en el tratamiento de los queloides con TBA, los datos actualmente disponibles son extremadamente limitados, con deficiencias significativas en los estudios de campo, cortos periodos de tiempo y una medición de los resultados muy heterogénea.
Es necesario prestar especial atención a pacientes que padecen timoma. La miastenia gravis es el síndrome paraneoplásico más común diagnosticado en estos pacientes. Se sabe que la TBA está contraindicada en pacientes que padecen enfermedades neuromusculares como la mencionada miastenia gravis, la esclerosis lateral amiotrófica y el síndrome de Eaton Lambert6,8,19‑22.
Es preciso, considerar el riesgo de formación de anticuerpos neutralizantes de la TBA en pacientes tratados con anticuerpos monoclonales, especialmente en el caso de fármacos inmunoterapéuticos. La TBA, el ácido hialurónico y la hidroxiapatita cálcica han demostrado ser útiles para mejorar asimetrías, dar volumen a las depresiones quirúrgicas y disimular cicatrices atróficas en los pacientes oncológicos23.
Numerosas publicaciones sugieren la utilidad de las inyecciones de TBA en los síndromes de dolor secundarios a la presión directa de la masa neoplásica o el dolor neuropático en las áreas en las que se practica la cirugía del cáncer o la radiación posterior. En cuanto a los estudios sobre la infiltración de TBA en el dolor neuropático se observan disparidades en la vía de administración24. Los estudios sobre el alivio del dolor crónico son alentadores, sugiriendo eficacia y seguridad de los tres tipos de neurotoxina tipo A; sin embargo, todos están limitados por el pequeño número de pacientes estudiados. Se precisan estudios doble ciego y controlados con placebo para respaldar o refutar su eficacia. Hasta ahora la única indicación aprobada de la TBA en el dolor ha sido en la migraña crónica25.
En algunos estudios se ha observado que la adición de TBA a un cultivo de células cancerosas reduce el crecimiento celular, induce apoptosis, y radiosensibiliza a las células de melanoma. Estos resultados iniciales resultan muy prometedores y alentadores, aunque los estudios deben consolidarse4.
Por último, comienzan a publicarse estudios que avalan el uso seguro de la TBA en el paciente oncológico con finalidad estética para corrección de arrugas faciales23. Hay que señalar como principales limitaciones de los estudios analizados el escaso número de participantes incluidos y la falta de una metodología estandarizada para objetivar resultados.
Conclusiones
La seguridad y eficacia del uso de la TBA en el paciente oncológico está avalada científicamente con un número cada vez es mayor de estudios y publicaciones. Las nuevas indicaciones no dejan de crecer, aunque precisan ser confirmadas y protocolizadas debidamente.
La utilización de la TBA con finalidad estética es segura en el paciente oncológico si se conocen bien sus límites, interacciones e indicaciones. No cabe duda que el empleo de la TBA en los pacientes oncológicos contribuye a la mejora de su calidad de vida. Aunque es deseable que se desarrollen nuevos estudios bien diseñados que incluyan un mayor número de pacientes para objetivar mejor los resultados.
Agradecimiento
Al Dr. Fernando García Monforte, quien ha contribuido con su conocimiento y experiencia sobre la TBA al desarrollo del presente trabajo.
Bibliografía
- Bach CA, Wagner I, Lachiver X, Baujat B, Chabolle F. Botulinum toxin in the treatment of post-radiosurgical neck contracture in head and neck cancer: a novel approach. Eur Ann Otorhinolaryngol Head Neck Dis. 2012 Feb;129(1):6‑10. https://doi.org/10.1016/j.anorl.2011.07.002
- Proietti I, Skroza N, Mambrin A, Marraffa F, Tolino E, Bernardini N, Marchesiello A, Rossi G, Volpe S, Potenza C. Aesthetic Treatments in Cancer Patients. Clin Cosmet Investig Dermatol. 2021 Dec 4;14:1831‑1837. https://doi.org/10.2147/CCID.S342734
- Grégoire C, Faymonville ME, Vanhaudenhuyse A, Jerusalem G, Willems S, Bragard I. Randomized controlled trial of a group intervention combining self-hypnosis and self-care: secondary results on self-esteem, emotional distress and regulation, and mindfulness in post-treatment cancer patients. Qual Life Res. 2021 Feb;30(2):425‑436. https://doi.org/10.1007/s11136-020‑02655‑7
- Grenda T, Grenda A, Krawczyk P, Kwiatek K. Botulinum toxin in cancer therapy-current perspectives and limitations. Appl Microbiol Biotechnol. 2022 Jan;106(2):485‑495. https://doi.org/10.1007/s00253-021‑11741‑w
- Padda IS, Tadi P. Botulinum Toxin. 2022 Jul 11. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan.
- Park HJ, Lee Y, Lee J, Park C, Moon DE. The effects of botulinum toxin A on mechanical and cold allodynia in a rat model of neuropathic pain. Can J Anaesth. 2006 May;53(5):470‑7. https://doi.org/10.1007/BF03022619
- Matak I, Bölcskei K, Bach-Rojecky L, Helyes Z. Mechanisms of Botulinum Toxin Type A Action on Pain. Toxins (Basel). 2019 Aug 5;11(8):459. https://doi.org/10.3390/toxins11080459
- Rostami R, Mittal SO, Radmand R, Jabbari B. Incobotulinum Toxin‑A Improves Post-Surgical and Post-Radiation Pain in Cancer Patients. Toxins (Basel). 2016 Jan 13;8(1):22. https://doi.org/10.3390/toxins8010022
- Mittal SO, Jabbari B. Botulinum Neurotoxins and Cancer‑A Review of the Literature. Toxins (Basel). 2020 Jan 5;12(1):32. https://doi.org/10.3390/toxins12010032
- Teymoortash A, Pfestroff A, Wittig A, Franke N, Hoch S, Harnisch S, Schade-Brittinger C, Hoeffken H, Engenhart-Cabillic R, Brugger M, Strauch K. Safety and Efficacy of Botulinum Toxin to Preserve Gland Function after Radiotherapy in Patients with Head and Neck Cancer: A Prospective, Randomized, Placebo-Controlled, Double-Blinded Phase I Clinical Trial. PLoS One. 2016 Mar 18;11(3):e0151316. https://doi.org/10.1371/journal.pone.0151316
- Layeeque R, Hochberg J, Siegel E, Kunkel K, Kepple J, Henry-Tillman RS, Dunlap M, Seibert J, Klimberg VS. Botulinum toxin infiltration for pain control after mastectomy and expander reconstruction. Ann Surg. 2004 Oct;240(4):608‑13; discussion 613‑4. https://doi.org/10.1097/01.sla.0000141156.56314.1f
- Zikiryakhodzhaev AD, Alekseeva GS, Reshetov IV, Starkova MV, Saribekyan EK, Usov FN, Vlasova MY. Botulinum Toxin Type A as a Tool for Correcting Capsular Contracture after Reconstructive Breast Surgery. Plast Reconstr Surg Glob Open. 2021 Jan 25;9(1):e3372. https://doi.org/10.1097/GOX.0000000000003372
- Shaw L, Bazzell AF, Dains JE. Botulinum Toxin for Side-Effect Management and Prevention of Surgical Complications in Patients Treated for Head and Neck Cancers and Esophageal Cancer. J Adv Pract Oncol. 2019 Jan‑Feb;10(1):40‑52. https://doi.org/10.6004/jadpro.2019.10.1.3
- Gómez Martín C, Fonseca Valero R, Galán Fajardo JM. Utilización de la toxina botulínica para mejorar la funcionalidad y la expresión del labio en parálisis facial de larga evolución. Cir. Plást. Iberolatinoam. 2010;36(2):175‑178.
- Alam M, Barrett KC, Hodapp RM, Arndt KA. Botulinum toxin and the facial feedback hypothesis: can looking better make you feel happier? J Am Acad Dermatol. 2008 Jun;58(6):1061‑72. https://doi.org/10.1016/j.jaad.2007.10.649
- Bi M, Sun P, Li D, Dong Z, Chen Z. Intralesional Injection of Botulinum Toxin Type A Compared with Intralesional Injection of Corticosteroid for the Treatment of Hypertrophic Scar and Keloid: A Systematic Review and Meta-Analysis. Med Sci Monit. 2019 Apr 22;25:2950‑2958. https://doi.org/10.12659/MSM.916305
- Sohrabi C, Goutos I. The use of botulinum toxin in keloid scar management: a literature review. Scars Burn Heal. 2020 Jun 26;6:2059513120926628. https://doi.org/10.1177/2059513120926628
- Oh HM, Chung ME. Botulinum Toxin for Neuropathic Pain: A Review of the Literature. Toxins (Basel). 2015 Aug 14;7(8):3127‑54. https://doi.org/10.3390/toxins7083127
- Park J, Park HJ. Botulinum Toxin for the Treatment of Neuropathic Pain. Toxins (Basel). 2017 Aug 24;9(9):260. https://doi.org/10.3390/toxins9090260
- Matak I, Lacković Z. Botulinum toxin A, brain and pain. Prog Neurobiol. 2014 Aug‑Sep;119‑120:39‑59. https://doi.org/10.1016/j.pneurobio.2014.06.001
- Bach-Rojecky L, Lacković Z. Central origin of the antinociceptive action of botulinum toxin type A. Pharmacol Biochem Behav. 2009 Dec;94(2):234‑8. https://doi.org/10.1016/j.pbb.2009.08.012
- Schnorr NGP, Salazar-Gamarra R, Latuff DC, Dib LL. Oculofacial Prosthetic Rehabilitation Complemented With Temporary Fillers and Neurotoxin. J Craniofac Surg. 2022 Jul‑Aug 01;33(5):e482‑e488. https://doi.org/10.1097/SCS.0000000000008388
- Moon YE, Choi JH, Park HJ, Park JH, Kim JH. Ultrasound-Guided Nerve Block with Botulinum Toxin Type A for Intractable Neuropathic Pain. Toxins (Basel). 2016 Jan 8;8(1):18. https://doi.org/10.3390/toxins8010018
- Sandrini G, Perrotta A, Tassorelli C, Torelli P, Brighina F, Sances G, Nappi G. Botulinum toxin type‑A in the prophylactic treatment of medication-overuse headache: a multicenter, double-blind, randomized, placebo-controlled, parallel group study. J Headache Pain. 2011 Aug;12(4):427‑33. https://doi.org/10.1007/s10194-011‑0339‑z
- Hu W, Zhu L, Pei W, Pan S, Guo Z, Wu A, Pei H, Nie J, Li B, Furusawa Y, Konishi T, Hei TK, Zhou G. Overexpression of Ras-Related C3 Botulinum Toxin Substrate 2 Radiosensitizes Melanoma Cells In Vitro and In Vivo. Oxid Med Cell Longev. 2019 Jun 2;2019:5254798. https://doi.org/10.1155/2019/5254798


