Valoración ecográfica de las medidas
de la banda subepidérmica
de baja ecogenicidad tras
un tratamiento con PRP
low-echogenicity band measurements
after PRP treatment
Introducción
El envejecimiento cutáneo es un fenómeno biológico que consta de dos componentes: intrínseco y extrínseco. El intrínseco está genéticamente determinado y se manifiesta con pérdida de colágeno, degeneración de la red de fibras elásticas y disminución de la hidratación; el extrínseco depende de factores ambientales como la radiación ultravioleta (UVA, UVB), luz visible e infrarroja (IR); por ello se define como fotoenvejecimiento (FEV). Se caracteriza por alteraciones celulares y desorganización de la matriz extracelular; presenta arrugas más profundas y prematuras, lentigos, telangiectasias, pigmentación amarillenta y disminución de la elasticidad y turgencia de la piel1. El FEV tiene mayor incidencia en fototipos claros (I, II y III en la escala de Fitzpatrick), que en los fototipos más oscuros2,3.
Para el estudio se tuvo en cuenta la clasificación de Glogau, que divide el grado de fotoenvejecimiento en cuatro grupos: leve, moderado, avanzado y severo; basándose predominantemente en la medición de la severidad de las arrugas4‑6.
En los últimos años se han desarrollado varias técnicas cuya finalidad es actuar sobre el envejecimiento cutáneo, entre las cuales el plasma rico en plaquetas (PRP) se propone para ayudar en la regeneración del tejido dañado, a través de la liberación de múltiples factores de crecimiento (FC) con capacidad biológica específica, involucrados en las diferentes fases de la regeneración tisular. Su finalidad sería la síntesis de nuevo colágeno, remodelación dérmica y angiogénesis. Además, el PRP actúa sobre la migración celular, adhesión, proliferación y diferenciación celular7.
El PRP es un producto autólogo, que precisa la extracción de sangre venosa y su posterior centrifugación para aumentar de 3 a 8 veces la concentración plaquetaria basal habitual en sangre (150.000 – 350.000 plaquetas/µL). Existen varios equipos e instrumentos para simplificar la preparación del PRP. La técnica cerrada (empleada en este estudio) implica el uso de un sistema o kit comercializado con marcaje CE, que no permite exponer la sangre extraída ni su procesamiento directamente al medio ambiente, aisla el PRP en su interior, impide la contaminación y permite su utilización en áreas no estériles.
El procedimiento requiere poco volumen de sangre. La muestra sanguínea adquirida por venopunción se recoge en tubos con citrato como anticoagulante. La sangre se somete a una única o doble centrifugación, dependiendo del equipo. Al finalizar el centrifugado, el tubo presenta 3 capas: en la capa inferior se encuentran los hematíes y los leucocitos depositados justamente por encima; la capa media corresponde al PRP y la capa superior al PPP (plasma pobre en plaquetas)8,9.
En el manejo del PRP se discute sobre la presencia o no de leucocitos y la activación plaquetaria. Consideramos que la fracción leucocitaria no debe ser incluida en los fines propuestos y también que la activación plaquetaria previa es necesaria para la liberación de los FC contenidos en los gránulos alfa de las plaquetas.
El PRP obtenido se puede aplicar, una vez activado, mediante mesoterapia, consistente en inyecciones en la dermis punto a punto. Los tres principales activadores son: colágeno, trombina y calcio. Cuando el PRP está sobreactivado se forma una red bivalente inestable de fibrina, observándose que el PRP activado de forma más fisiológica produce una red tetramolecular más estable y con más adherencia de los FC a sus receptores en las células10,11. Aunque actualmente no resulta claro que la activación sea beneficiosa, es aceptado universalmente que la activación del PRP cambia sus propiedades y puede influenciar en su eficacia clínica12.
Tanto la fracción de PRP como la fracción de PPP han demostrado tener un efecto mitógeno sobre los fibroblastos, aunque en diferente medida13; de ahí su posible utilidad en el tratamiento de la piel fotoenvejecida, que muestra disminución de fibroblastos, atrofia dérmica y aplanamiento de uniones dermo-epidérmicas14.
Significado de la Banda Subepidérmica de Baja Ecogenicidad
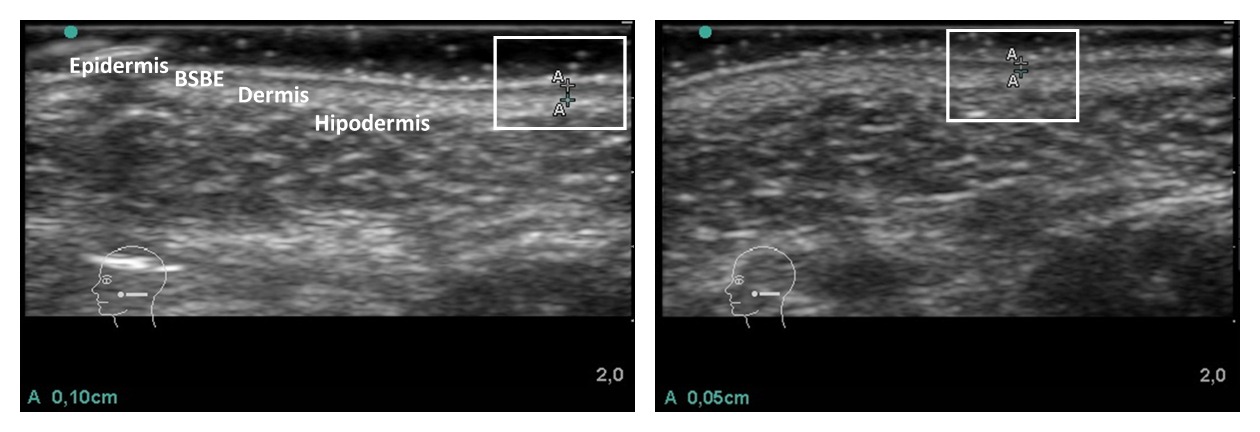
En las últimas décadas, la ecografía ha alcanzado relevancia como un método eficaz, preciso y no invasivo de medición cuantitativa de los cambios cutáneos que caracterizan el fotoenvejecimiento de la piel15,16. La ecografía identifica los estratos de la piel (epidermis, dermis) y del tejido subcutáneo. A frecuencias mayores de 10 MHz se dispone de suficiente resolución para identificar cambios en el grosor y la ecogenicidad de los componentes de la piel relacionados con el envejecimiento17‑19. En 1989, de Rigal et al demostraron la presencia de una banda de baja ecogenicidad en la dermis papilar (Figura 1) en pieles envejecidas comprobando que su grosor aumentaba con la edad20. La denominaron Banda Subepidérmica de Baja Ecogenicidad (BSBE), en inglés Sub‑epidermal Low Echogenicity Band (SLEB), y se ha propuesto como un marcador de envejecimiento21. Además, se vio que el cambio en el grosor era más evidente en áreas fotoexpuestas22.
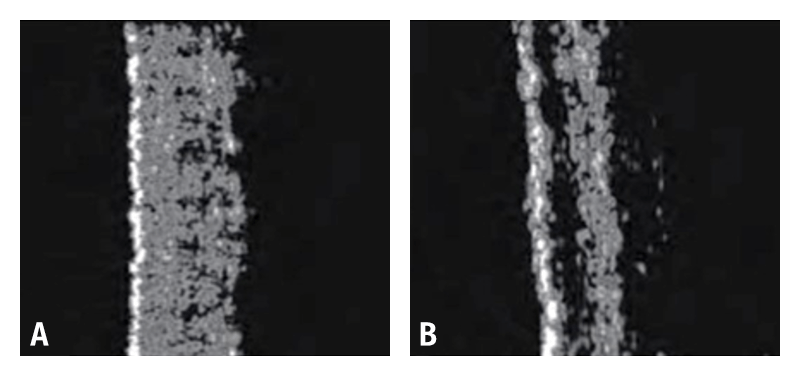
Otros estudios han demostrado que la ecogenicidad de la BSBE es inversamente proporcional a la exposición crónica a rayos UV23. La presencia de la BSBE podría considerarse como una manifestación de la elastosis y del edema en dermis papilar, y aunque representa un artefacto de la refracción del haz de ultrasonidos, se ve más incrementado en el fotoenvejecimiento porque las alteraciones son mayores, y puede ser aprovechado como una medida indirecta que se correlaciona bien cuando se compara con la histología21‑23.
El objetivo del estudio que se presenta es valorar la eficacia de la aplicación del PRP autólogo en una única sesión, mediante la medición ecográfica de la BSBE, en pacientes con grado diverso de fotoenvejecimiento.
Materiales y método
Es un estudio prospectivo, longitudinal y multicéntrico. Se realizó de marzo a junio de 2019 en Clínica Alcolea (Hospitalet de Llobregat, Barcelona) y LeClinics (Barcelona). Se llevó a cabo de acuerdo con los principios de la Declaración de Helsinki de la Asociación Médica Mundial.
Pacientes
Se inició con 62 pacientes adultos de sexo femenino, con edades de 30 a 65 años (media 45,77 ± 8,99); de las cuales completaron el estudio 55.
Las pacientes se dividieron en dos grupos, por consenso de los investigadores, a fin de verificar si había diferencias significativas al comparar ambos. El grupo 1 lo integraron 25 pacientes, de 30 a 44 años; en el grupo 2 se incluyeron 30 pacientes de 45 a 65 años. Todas las pacientes tenían fototipos II y III de la clasificación de Fitzpatrick. También se constató que un 25% de las pacientes eran fumadoras. Todas las pacientes fueron debidamente informadas del propósito específico de este estudio y otorgaron su consentimiento expreso antes de realizar el procedimiento.
Los criterios de inclusión fueron:
- Sexo femenino.
- Participación voluntaria.
- Edad de 30 a 65 años.
- Fototipos II y III.
- Fotoenvejecimiento (según escala de Glogau).
Los criterios de exclusión fueron:
- Pacientes que hubieran realizado algún tratamiento estético 12 meses antes del estudio.
- Pacientes que hubieran realizado en el último año tratamiento de PRP.
- Cicatrización anómala, tal que queloides.
- Embarazo.
- Lactancia.
- Trombocitopenia.
- Trastornos neurológicos.
- Trastornos psíquicos.
- Trastornos hematológicos.
A todas las pacientes se les aplicó un anestésico tópico en crema, tipo EMLA® (Aspen Pharma, Dublin, Irlanda), previa limpieza y desinfección de la cara, 30 minutos antes del tratamiento. Tras retirar el anestésico se repitió el proceso de desinfección con clorhexidina.
Al finalizar el procedimiento se colocó Heliocare® 360 Fluid Cream SPF 50+ (Cantabria Labs, Santander, España).
Valoración objetiva
Se llevó a cabo una valoración ecográfica en cada paciente, antes y 2 meses después de haber realizado una sesión única de tratamiento con PRP. Se empleó un ecógrafo Sonosite MicroMaxx® (Sonosite Inc; Bothell, (Bothell, WA 98021, USA), conectado a una sonda lineal multifrecuencia de 6 a 15 MHz. Las mediciones se hicieron con las pacientes en sedestación, aplicando la sonda sobre una línea imaginaria trazada desde el punto inferior del ala nasal hasta el punto inferior del trago. Se tuvo cuidado de no ejercer presión sobre la piel, observando que quedaba una separación, con gel interpuesto, entre la sonda y la epidermis.
Valoración subjetiva
Se pidió a las pacientes estudiadas que completaran un cuestionario de valoración teniendo en cuenta: dolor en el momento de la inyección, dolor posterior a la inyección, si hubo imposibilidad en realizar la actividad diaria habitual, presencia de eritema y/o edema; así como el grado de satisfacción, y si repetirían o recomendarían el tratamiento.
Técnica de obtención y preparación del PRP
El procedimiento de extracción del PRP se realizó bajo las normas del Informe V1/23052013 de la Agencia Española de Medicamentos y Productos Sanitarios sobre el uso de PRP.

El PRP se obtuvo usando el kit RegenACR‑C® Classic (Regen Lab, Mont-sur-Lausanne, Suiza), de doble envase esterilizado por irradiación gamma, sistema cerrado y con marcaje CE. El Kit está equipado con aguja mariposa 21G Safety‑Lok®, tulipa de extracción, tubo Regen BCT® (Blood Cell Therapy) con gel de separación entre leucocitos y PRP, jeringa Luer‑lock de 3 ml, aguja y dispositivo de transferencia.
Se utilizó la centrifugadora Regen Lab®, del mismo laboratorio, con los siguientes parámetros: tiempo de centrifugación de las muestras 5 minutos, fuerza centrífuga relativa (FCR): 1500 g, a 1800 revoluciones por minuto (rpm).
Se extrajo una muestra de sangre venosa de 10 ml de sangre, que permite obtener aproximadamente 6 ml de plasma por tubo, separado por 2 fracciones: las dos terceras partes superiores corresponden a PPP (4 ml) y el tercio inferior es PRP (2 ml). Por debajo se encuentra la fracción leucocitaria y, por último, la fracción eritrocitaria. Estos kits permiten separar la fracción plasmática de la leucocitaria a través de un gel interpuesto, adicionado al tubo por el fabricante (Figura 2).
La fracción de PRP se obtuvo por aspiración con jeringa de 3 ml previamente conectada al dispositivo de transferencia. La activación plaquetaria, para liberar los factores de crecimiento, se hizo añadiendo 0,1 ml de cloruro cálcico (CaCl₂) al 10% por cada ml de PRP. Una vez activado, el proceso de infiltración dérmica debe ser rápido, pues transcurridos unos 8 minutos el plasma adquiere una consistencia gelatinosa, debido a la coagulación ex vivo que imposibilita su inyección.
Técnica de inyección
Tras la retirada de la crema anestésica, y previa limpieza y desinfección, se inyectaron intradérmicamente 4 ml de PRP, 2 ml por cada hemicara. Las jeringas se activaron inmediatamente antes de inyectar cada una. Se empleó técnica de mesoterapia (intradermoterapia) puntual con aguja 30 G ½.
Análisis estadístico
Se tuvieron en cuenta máximos, mínimos, media y desviación estándar en los parámetros estudiados. El análisis estadístico se realizó mediante un estudio t de Student, para muestras relacionadas e independientes, análisis de la varianza (ANOVA) y prueba de Lavene para pruebas no paramétricas. Se consideró estadísticamente significativo un valor de p < 0,05.
Resultados
El test t de Student para muestras relacionadas, teniendo en cuenta los valores ecográficos encontrados de las medias de BSBE pre-tratamiento (p=0,249) como en las post-tratamiento (p=0,762), evidenció que no hubo diferencias estadísticamente significativas (p > 0,05) entre las mediciones de la BSBE obtenidas en el lado derecho y en el izquierdo de la cara (Tabla I). Por lo tanto, se consideró el valor medio de la BSBE de las dos hemicaras como una única variable.
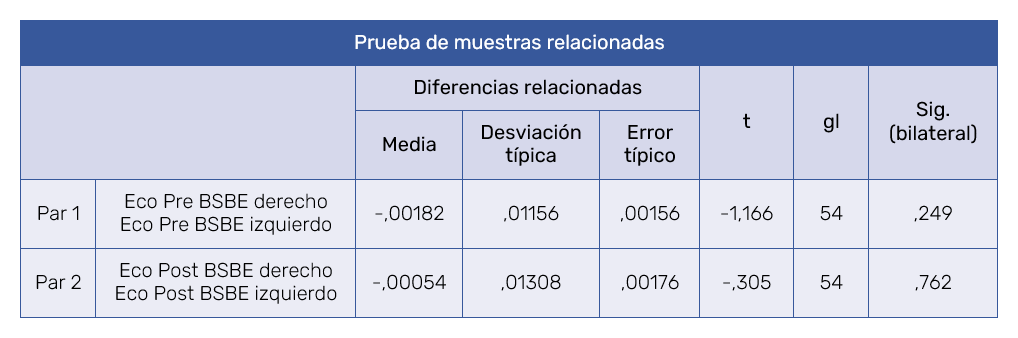
Los valores ecográficos de la BSBE (entendido como valor medio entre los dos lados del rostro) pre-tratamiento, mostraron un valor mínimo de 0,015 mm y un máximo de 0,1 mm (media 0,055 ± 0,022 mm). El mismo cálculo referido a las mediciones ecográficas post-tratamiento evidenció valor mínimo de 0,01 mm hasta un máximo de 0,075 mm (media 0,042 ± 0,015 mm).
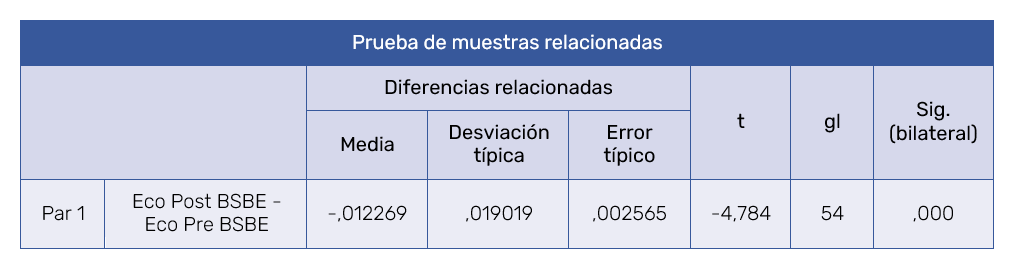
La eficacia del tratamiento con PRP, entendido como disminución del grosor de la BSBE, se evidenció mediante reducción de los valores medios de la BSBE (media ‑0,012 mm) tras tratamiento con PRP y fue estadísticamente significativa (p < 0,05) (Tabla II).
También se valoró la eficacia del tratamiento en los dos subgrupos de edad. Según el análisis estadístico de grupos la diferencia de la medición de la BSBE pre y post tratamiento resultó con un valor medio de 0,008 ± 0,18 mm en el grupo de 30 a 44 años (n=25) y 0,156 ± 0,19 mm en el grupo 45 a 66 años (n=30). Dado que las medias son diferentes, la prueba de Lavene para verificar las varianzas de ambos grupos, se sigue del test t de Student, que no evidenció diferencias estadísticamente significativas (p > 0,05) según la segmentación por franja de edad de las pacientes (Tabla III).

Tampoco hubo diferencias estadísticamente significativas en las modificaciones de la BSBE pre y post tratamiento entre pacientes fumadoras y no fumadoras; lo mismo puede decirse respecto de los fototipos (II y III), de cuyo análisis se infiere que el fototipo de piel no resulta significativo (p > 0,05) en la medición de la BSBE.
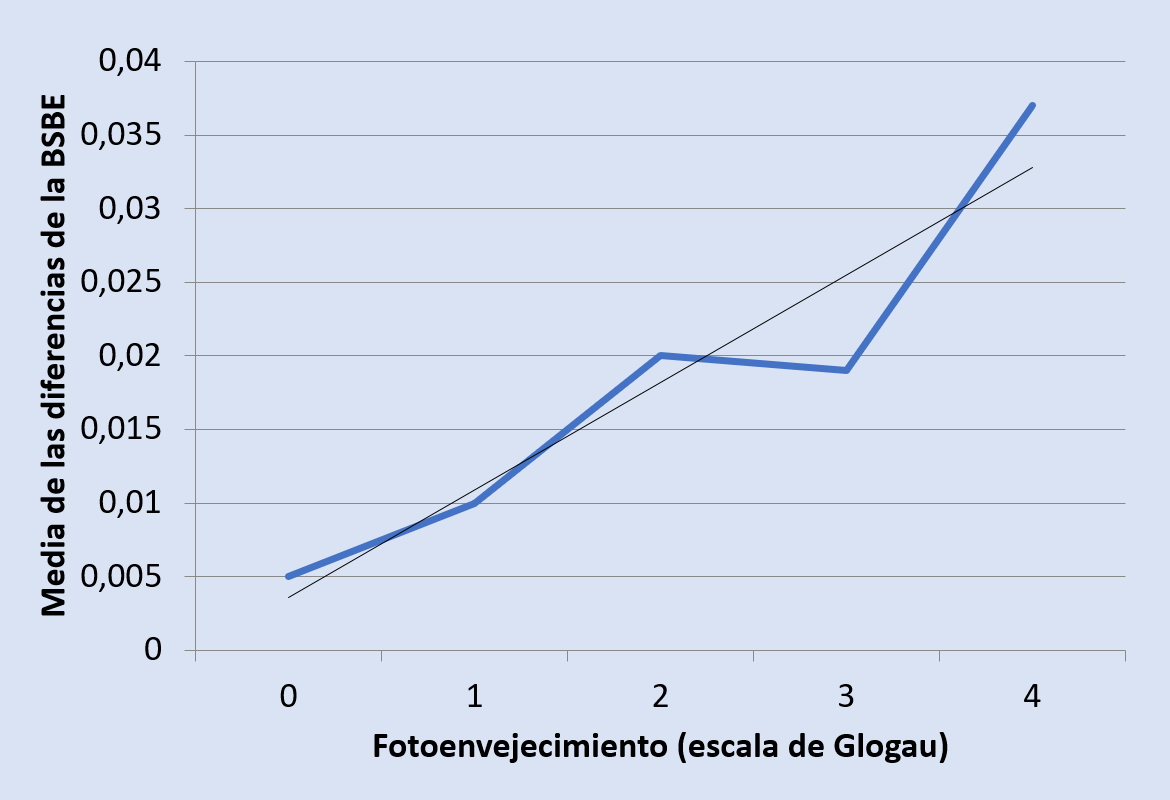
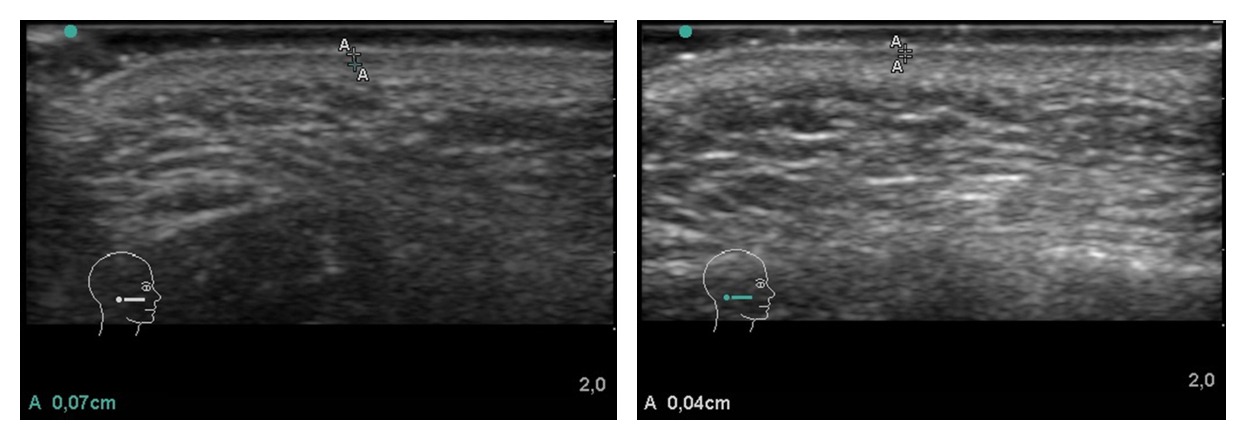
En todas las pacientes se valoró el grado de fotoenvejecimiento (media 2,255 ± 1,004), según escala de Glogau, evidenciando una correlación significativa en la diferencia entre los valores BSBE anteriores y posteriores al tratamiento, con más disminución del grosor de la BSBE a mayor grado de fotoenvejecimiento (Figura 3). La medición ecográfica hizo posible la obtención de los valores BSBE, evidenciando la eficacia del tratamiento con una sola sesión de PRP (Figuras 4 y 5).
También se tuvieron en cuenta los posibles efectos adversos: un 62% de las pacientes (n=34) refirieron dolor durante el procedimiento, que se cuantificó en todos los casos por debajo de 6 en una escala de 1 a 10. El 93% de las pacientes (n=51) manifestaron que no tuvieron dolor tras las inyecciones. Ninguna paciente tuvo imposibilidad de continuar con su actividad diaria por causa del tratamiento. Se refirieron y registraron efectos adversos menores como equimosis, eritema y/o edema, considerados leves y que se resolvieron en un intervalo de 2 a 4 días.
El 73% de las pacientes manifestaron estar satisfechas o muy satisfechas con el tratamiento. Además, el mismo porcentaje (73%) manifestó que recomendarían y repetirían nuevas sesiones del mismo tratamiento. Sin embargo, la variable satisfacción no se demostró que tuviera relación con el resultado ecográfico obtenido (p > 0,05), en términos de diferencia de la BSBE pre y post-tratamiento, cuando se calculó como factor independiente.
Discusión
Los estudios sobre el modo de actuación del PRP señalan, como resultado más relevante, el aumento de elasticidad de la piel a expensas de la proliferación y diferenciación de queratinocitos y fibroblastos, junto al incremento de colágeno23. También se cree que el PRP puede inducir la eliminación de componentes fotodañados de la matriz extracelular, estando directamente implicados determinados FC liberados tras la activación plaquetaria; aunque cabe añadir que el mecanismo íntimo de actuación no se conoce de forma completa. No obstante, se sabe que algunos FC pueden permanecer activos hasta 8 horas; especialmente si la cantidad de plaquetas activadas por microlitro supera el 1.000.000, considerando que se liberarían suficientes FC como para obtener resultados terapéuticos satisfactorios17,18. Sin embargo, otros autores inciden en la importancia de una mayor integridad de las plaquetas obtenidas que en su número; las plaquetas dañadas en cualquiera de las etapas del proceso de su obtención vaciarían sus gránulos alfa y el efecto terapéutico sería escaso15,16,18,20.
En la misma línea se discute sobre la forma más idónea de liberar los FC. Hay investigadores que sugieren la vía de activación natural a través del colágeno tisular, inyectando directamente el PRP sin activar, aduciendo que la activación se produciría a través del colágeno existente en el tejido, permitiendo una liberación más gradual de los FC, similar a la respuesta normal de la regeneración fisiológica20. Hay estudios en ratones, aunque cada particular condición y metodología debe tenerse muy en cuenta a la hora de valorar, y, sobre todo, extrapolar conclusiones12.
Abuaf et al, en un estudio prospectivo controlado sobre 20 pacientes de sexo femenino y edad entre 40 y 49 años, evaluaron la eficacia del PRP para el tratamiento de los signos del envejecimiento facial22. Tras un único tratamiento de PRP, con técnica de mesoterapia punto a punto, se evidenció un aumento en los niveles de colágeno en la dermis. Se comprobó, a través de biopsias, que había diferencia estadísticamente significativa de aumento de colágeno con respecto al grupo control tratado con suero fisiológico22. No obstante, cabe tener en cuenta que solo el efecto traumático de la aguja en el tejido es capaz de iniciar la neocolagénesis. En el presente estudio, también se obtienen resultados positivos, aunque validados a través de ecografías realizadas antes y 2 meses después de la terapia con PRP.
Cobos et al y Sciafani et al, en 2015, publicaron sendos artículos en donde se proponía que se precisaban, al menos, tres tratamientos para obtener mejores resultados23,24. Conde Montero et al se mostraron de acuerdo en una revisión publicada en 201625. En el presente estudio, solo se realizó un único tratamiento, con buen seguimiento y valoración posterior, pero nos inclinamos a pensar que 3 tratamientos podrían arrojar mejores resultados.
Alam et al, en un estudio clínico aleatorizado, realizado en 27 pacientes de ambos sexos con rango de edad entre 18 y 70 años, utilizaron como método de evaluación escalas de puntuación subjetiva. Comprobaron una mejora en luminosidad, turgencia y finas arrugas respecto a los controles, aunque sin valoración objetiva instrumental. En nuestro estudio, debido a la dificultad de citar a todas las pacientes, así como la dificultad de realizar una valoración conjunta con idéntica cámara y condiciones de luz por parte de los 3 autores, se prefirió no usar escalas de puntuación adicionales por los sesgos asociados a una tecnología deficiente, como es el empleo de las cámaras de los teléfonos móviles.
Ahora bien, a la vista de los estudios cotejados consideramos que la ecografía de alta frecuencia representa una técnica madura para visualizar y cuantificar los cambios en la dermis relacionados con la edad16‑18. Ya en 1989, De Rigal et al observaron una banda hipoecogénica en la región subepidérmica en pieles fotoenvejecidas27. Estos autores evidenciaron que el grosor de esta BSBE aumentaba en relación a la edad, por lo que propusieron adoptar este parámetro como marcador de envejecimiento. Tras comprobar que el grosor aumentaba en áreas mayormente fotoexpuestas, consideraron que el valor de la BSBE era un adecuado marcador del fotoenvejecimiento31. Otros estudios clínicos han confirmado que la presencia de una BSBE bien definida puede asumirse como marcador del fotoenvejecimiento16,17.
Crisan et al (2012), propusieron que la BSBE se considerase el equivalente ecográfico de la zona de Grenz como expresión de la elastosis presente en áreas fotoexpuestas. Sin embargo, en la descripción original la zona de Grenz es una banda fina localizada por debajo de la epidermis, correspondiente a un área de regeneración tisular sobre la que asientan lesiones actínicas o cancerosas21. No creemos que el significado pueda ser el mismo, pues las histologías difieren de modo significativo, ya que la fotoexposición acusada puede conducir a lesiones actínicas y cáncer cutáneo, pero es una entidad en evolución hacia, no una lesión plenamente constituida. Preferimos seguir considerándola una buena ayuda de evaluación, aunque los estudios histológicos de alta resolución, sin duda, ayudarán a dilucidar esta cuestión.
En nuestro estudio se comprobó una disminución en el grosor de la BSBE en la mayoría de las pacientes tratadas, 2 meses después de un único tratamiento, que fue estadísticamente significativo (p < 0,05), confirmando la eficacia del tratamiento. Además, al valorar el grado de fotoenvejecimiento (2,255 ± 1,004) según escala de Glogau, se constató una diferencia de la variable BSBE directamente proporcional al nivel de fotoenvejecimiento: es la variable que mejor respuesta ha tenido al tratamiento con PRP.
Acorde con la literatura, ningún efecto adverso importante se ha descrito23‑25. Solo se observaron efectos secundarios esperados y acordes con la técnica de inyección, sin que su número fuera estadísticamente significativo, con rápida resolución en pocos días. En nuestra práctica, según los resultados del cuestionario de valoración de posibles complicaciones, se evidenció que el 38% de pacientes refirieron dolor durante el procedimiento inferior a 6 sobre una escala de 1 a 10; aunque es destacable que el 92,7% solo presentaron dolor asociado a las inyecciones, no posterior. También cabe mencionar que, de acuerdo con el análisis de satisfacción subjetiva, más del 70% de las pacientes resultaron satisfechas o muy satisfechas. El 73% repetiría y recomendaría el tratamiento.
Sin embargo, y de acuerdo al análisis estadístico, la satisfacción de las pacientes no se relacionó con el resultado ecográfico obtenido. Lo consideramos debido a que otras variables, tales que luminosidad de la piel, cambios en finas arrugas, o la mejoría de la textura dérmica, entre otras, no se tuvieron en cuenta por depender de valoraciones muy subjetivas. El fin del estudio de encontrar un método lo más objetivo posible para poder validar la eficacia del tratamiento se ha cumplido. Aunque objetivamente no existe correlación estadísticamente significativa entre la variable satisfacción y la medición de la BSBE, no cabe duda de que la medicina satisfactiva juega un rol importante en la medicina estética. En estudios futuros deben tenerse en cuenta todos los detalles mencionados, pues sin duda arrojarán nueva luz sobre la eficacia y satisfacción en tratamientos con PRP como protagonista.
Conclusiones
Este estudio muestra una disminución estadísticamente significativa en el grosor de la BSBE que puede atribuirse a la acción de PRP.
No se han encontrado diferencias estadísticamente significativas en las variables edad, fototipo de piel y tabaquismo.
Se ha evidenciado una relación directamente proporcional entre el grado de fotoenvejecimiento de la piel y la disminución de la banda ecogénica.
El 73% de las pacientes se mostraron satisfechas, repetirían y recomendarían el tratamiento.
La medición ecográfica del BSBE podría representar un método objetivo, seguro y no invasivo para la valoración de la eficacia de los tratamientos de bioestimulación en general, y del PRP en particular, destinados a paliar los efectos del fotoenvejecimiento cutáneo.
Nuevos estudios, metodológicamente bien diseñados y con mayor número de sesiones, son necesarios a fin de establecer una correlación fiable entre la disminución del BSBE y el grado de fotoenvejecimiento.
Declaración
Los autores manifiestan que no tienen ningún tipo de conflicto de intereses con los productos o aparatos arriba mencionados.
El presente artículo deriva del Trabajo Fin de Máster (TFM) de las 3 primeras autoras y fue tutorizado por el Dr. Justo M. Alcolea, que certificó su contribución al mismo a partes iguales. El TFM recibió una beca de ayuda de la SEME para su realización.
Bibliografía
- Uitto J. The role of elastin and collagen in cutaneous aging: Intrinsic aging versus photoexposure. J Drugs Dermatol. 2008; 7: s12‑6.
- Thomas B Fitzpatrick, Richard Allen Johnson, Klaus Wolff, Dick Suurmond. Color atlas and synopsis of clinical dermatology, common and serious diseases. 9ª Ed. Estados Unidos: McGrawHill; 2001; p.212.
- Han A, Chien AL, Kang S. Photoaging. Dermatol Clin. 2014; 32; 291‑299. https://doi.org/10.1016/j.det.2014.03.015
- Carruthers A, Carruthers J. A validated facial grading scale: the future of facial ageing measurement tools? J Cosmet Laser Ther. 2010; 12(5): 235‑41. https://doi.org/10.3109/14764172.2010.514920
- Glogau RG. Aesthetic and anatomic analysis of the aging skin. Semin Cutan Med Surg. 1996; 15(3): 134‑8. https://doi.org/10.1016/s1085-5629(96)80003-4
- Day DJ, Littler CM, Swift RW, et al. The wrinkle severity rating scale: a validation study. Am J Clin Dermatol. 2004; 5(1): 49‑52. https://doi.org/10.2165/00128071-200405010-00007
- Alves R, Grimalt R. A Review of platelet-rich plasma: History, Biology, Mechanism of Action, and Classification. Skin Appendage Disord. 2018; 4; 18‑24. https://doi.org/10.1159/000477353
- Lynch MD, Bashir S: Applications of platelet rich plasma in dermatology: a critical appraisal of the literature. J Dermatolog Treat. 2016; 27: 285‑289. https://doi.org/10.3109/09546634.2015.1094178
- Andia I, Rubio-Azpeitia E, Martin JI, Abate M. Current concepts and translational uses of platelet rich plasma biotechnology; in Ekinci D (ed.) 2015: Biotechnology. InTech. https://doi.org/10.5772/59954
- Kim DH, Je YJ, Kim CD, Lee YH, Seo YJ, Lee JH, et al. Can platelet-rich plasma be used for skin rejuvenation? Evaluation of effects of platelet-rich plasma on human dermal fibroblast. Ann Dermatol. 2011; 23: 424‑431. https://doi.org/10.5021/ad.2011.23.4.424
- Dohan Ehrenfest DM, Rasmusson L, Albrektsson T. Classification of platelet concentrates: from pure platelet-rich plasma (PPRP) to leucocyte- and platelet-rich fibrin (LPRF). Trends Biotechnol. 2009; 2: 158‑167. https://doi.org/10.1016/j.tibtech.2008.11.009
- Scherer SS, Tobalem M, Vigato E, et al. Non activated versus thrombin-activated platelets on wound healing and fibroblast-tomyofibroblast differentiation in vivo and in vitro. Plast Reconstr Surg. 2012; 129: 46e‑54e. https://doi.org/10.1097/prs.0b013e3182362010
- Kakudo N, Minakata T, Mitsui T, et al. Proliferation-promoting effect of platelet-rich plasma on human adipose-derived stem cells and human dermal fibroblasts. Plast Reconstr Surg. 2008; 122: 1352‑1360. https://doi.org/10.1097/prs.0b013e3181882046
- Çayırlı M, Çalıskan E, Açıkgöz G, Erbil A, Ertürk G. Regression of melasma with platelet-rich plasma treatment. Ann Dermatol. 2014; 26: 401‑402. https://doi.org/10.5021/ad.2014.26.3.401
- Serup J, Keiding J, Fullerton A, Gniadecka M, Gniadecki R. High-frequency ultrasound examination of skin: Introduction and guide. In: Serup J, Jemec GB, editors. In vivo examination of the skin: Handbook of noninvasive methods. Boca Raton, FL: CRC Press; 1995. p.239‑256.
- Gniadecka M, Jemec GB. Quantitative evaluation of chronological aging and photoaging in vivo: Studies on skin echogenicity and thickness. Br J Dermatol. 1998; 139: 815‑821. https://doi.org/10.1046/j.1365-2133.1998.02506.x
- Cammarota T, Pinto F, Magliaro A, Sarno A. Current uses of diagnostic high-frequency US in dermatology. Eur J Radiol. 1998; 27 Suppl 2: s215‑223. https://doi.org/10.1016/s0720-048x(98)00065-5
- Kanitakis J. Anatomy, histology and immunohistochemistry of normal human skin. Eur J Dermatol. 2002; 12: 390‑399.
- Sandby-Møller J, Poulsen T, Wulf HC. Epidermal thickness at different body sites: Relationship to age, gender, pigmentation, blood content, skin type and smoking habits. Acta Derm Venereol. 2003; 83: 410‑413. https://doi.org/10.1080/00015550310015419
- Gniadecka M. Effects of ageing on dermal echogenicity. Skin Res Technol. 2001; 7: 204‑207. https://doi.org/10.1034/j.1600-0846.2001.70310.x
- Crisan D, Lupsor M, Boca A, Crisan M, Badea R. Ultrasonographic assessment of skin structure according to age. Indian J Dermatol Venereol Leprol. 2012; 78: 519. https://doi.org/10.4103/0378-6323.98096
- De Rigal J, Escoffer C, Querleux B, Faivre B, Agache P, Lévêque JL. Assessment of aging of the human skin by in vivo ultrasonic imaging. J Invest Dermatol 1989: 93: 621‑624.
- Abuaf OK, Yildiz H, Baloglu H, Bilgili ME, Simsek HA, Dogan B. Using Platelet Rich Plasma in Skin Rejuvenation: A Prospective Controlled Clinical Study. Ann Dermatol. 2016; 28(6). https://doi.org/10.5021/ad.2016.28.6.718
- Cobos R, Aizpuru F, Parraza N, Anitua E, Orive G: Effectiveness and efficiency of platelet rich plasma in the treatment of diabetic ulcers. Curr Pharm Biotechnol 2015; 16:630‑634. https://doi.org/10.2174/138920101607150427111926
- Sclafani AP, Azzi J: Platelet preparations for use in facial rejuvenation and wound healing: a critical review of current literature. Aesthec Plast Surg. 2015; 39:495‑505. https://doi.org/10.1007/s00266-015-0504-x
- Conde Montero E. PRP in wound healing; in Alves R, Grimalt R (eds): Clinical Indications and Treatment Protocols with Platelet-Rich Plasma in Dermatology. Barcelona, Mayo, 2016, pp 59‑72.
- Alam M, Hughart R, Champlain A, Geisler A, Paghdal K, Whiting D, Hammel JA, Maisel A, Rapcan MJ, West DP, Poon E. Effect of Platelet-Rich Plasma Injection for Rejuvenation of Photoaged Facial Skin: A Randomized Clinical Trial. JAMA Dermatol. 2018; 154(12): 1447‑1452. https://doi.org/10.1001/jamadermatol.2018.3977
- Kumagai K, Koike H, Nagaoka R, Sakai S, Kobayashi K, Saijo Y. High-resolution ultrasound imaging of human skin in vivo by using three-dimensional ultrasound microscopy. Ultrasound Med Biol. 2012 Oct;38(10):1833‑8. https://doi.org/10.1016/j.ultrasmedbio.2012.05.012
- Waller JM, Maibach HI. Age and skin structure and function, a quantitative approach (I): blood flow, pH, thickness, and ultrasound echogenicity. Skin Res Technol. 2005 Nov;11(4):221‑35. https://doi.org/10.1111/j.0909-725X.2005.00151.x



