Tratamiento del acné en Vietnam:
evaluación retrospectiva
de la práctica diaria
restrospective evaluation of the daily practice
Introducción
El acné es una condición inflamatoria de la piel de la cara, el dorso y, en ocasiones, el pecho que afecta hasta el 65% de la población en algún momento de la vida, con un pico del 85% en el intervalo de los 12 a los 25 años1,2. Su incidencia ha ido aumentando en los últimos años sin poder atribuir la causa a la dieta occidental, a un adelanto de la pubertad, o a factores medioambientales. Un 64% de pacientes puede ver su acné prolongado hasta los 20 años, y un 43% hasta los treinta. Los descendientes de primer grado tienen hasta un 80% de posibilidades de sufrir acné como sus padres, y a edades más tempranas. El acné comedogénico es el más prevalente, seguido de las formas leves y del pápulo-pustular moderado. En un estudio el acné fue más prevalente en las etnias afroamericana (37%) y latina (32%) que en las etnias asiática (30%), caucásica (24%) o india (23%). En cuanto a las secuelas a largo plazo, la hiperpigmentación postinflamatoria también predominó en las etnias afroamericana (65%) y latina (48%) sobre los otros grupos (asiática 18%)3.
Patogénesis
La población general cree que la dieta y la higiene facial pueden tener relación con la presencia o severidad del acné4. Entre los estudiantes de medicina de un estudio el 67% consideró el estrés, el 41% la ingesta de chocolate, grasas y azúcares, el 25% la mala higiene facial y el 10% el tabaquismo como factores agravantes del acné4. La influencia de la exposición a la luz en el acné ha motivado diversos estudios. Un trabajo evidenció en Delhi que el 40% de 171 pacientes sufrió un agravamiento de su acné en verano5.
Así mismo, resultan de interés las investigaciones sobre subpoblaciones de Cutibacterium acnes, su estimulación con la aportación de vitamina B12 y la producción de porfirinas6. Esto explicaría el efecto de la luz solar en el acné inflamatorio (las porfirinas son fotosensibilizantes). Johnson y Kang presentan el fenómeno del acné como un desajuste entre el ecosistema de cepas comensales inflamatorias tipo IA‑2 (sensibles a la acción de la vitamina B12 y productoras de porfirinas) y cepas no inflamatorias tipo II de C. acnes6.
La implicación de los factores ambientales en la patogénesis parece débil; sin embargo, el papel de la herencia dispone de una evidencia más robusta. El estudio de Bataille et al basado en el análisis de la varianza en mujeres gemelas inglesas, sobre 458 pares de monocigóticas y 1099 pares de dicigóticas, halló que solo el 19% era atribuible a factores ambientales mientras que el 81% era atribuible a factores genéticos7.
El estímulo androgénico influye en la proliferación celular de las glándulas sebáceas y de los queratinocitos del canal piloso. La hiperqueratinización de los folículos bloquea el canal piloso y crea un ambiente anaerobio que es aprovechado por el C. acnes (antes Propionibacterium acnes), una bacteria Gram positiva anaerobia comensal. La rotura de la membrana basal del folículo expone las lipoproteínas del Cutibacterium a nuestro sistema inmune a través de los receptores Toll‑like‑2 y Toll‑like‑4, que estimulan la producción de las interleuquinas 6 y 8 en el queratinocito8, conduciendo a una reacción inflamatoria que producirá lesiones como pápulas, pústulas, quistes y nódulos, que regresarán a la normalidad al cabo del tiempo o dejarán secuelas en forma de cicatrices atróficas, queloides o discromías. La hiperproducción de sebo se halla ligada a la sensibilidad regional incrementada a los andrógenos circulantes, mayoritariamente testosterona y dihidrotestosterona, aunque los estrógenos, progesterona, insulina e ILGF‑I (Insulin-like growth factor I), ACTH, GH y melanocortina tienen su contribución9.
No es necesario efectuar investigaciones hormonales, excepto en acné de presentación tardía, o resistente al tratamiento, acné prepuberal o premenstrual, presencia de hiperandrogenismo o virilización, sospecha de ovarios poliquísticos, o signos de hiperinsulinemia (obesidad troncular, acantosis nigricans). En presencia de hiperandrogenismo, el síndrome de ovarios poliquísticos es responsable del 90% de los casos9.
Recientemente la histamina ha sido descrita como un factor relacionado con la producción de sebo y manifestaciones inflamatorias del acné. Pelle et al mediante técnicas de transcriptasa inversa e inmunofluorescencia codificaron e identificaron los receptores histamínicos del RNA de los sebocitos y los distinguieron como tipo H1, y no tipo H2. Cuando expusieron los sebocitos a difenhidramina, los niveles de escualeno disminuyeron significativamente a 2,37 nmol (± 0,24) en las células tratadas frente a 6,27 nmol (± 0,73) en las no tratadas10.
Tratamiento del acné
Los retinoides tópicos son comedolíticos y antiinflamatorios y regularizan la hiperproliferación de queratinocitos; representando la primera línea de tratamiento para el acné. Deberán mantenerse en el tiempo para evitar recidivas una vez terminado un tratamiento con isotretinoína oral11. Los retinoides tópicos más habituales son el adapaleno, la tretinoína (ácido al-trans-retinoico) y la isotretinoína (ácido 13‑cis retinoico). También se dispone del tazaroteno (en España, Zorac® 0,05% y 0,1%). La prescripción suele ser de uso diario y horario nocturno, a menos que aparezca irritación cutánea y deban espaciarse las aplicaciones. Se acepta que el tazaroteno 0,1% es más efectivo y el adapaleno 0,1% mejor tolerado. La efectividad de los retinoides se ha demostrado ser dosis dependiente11.
Además de controlar las lesiones primarias del acné, el tazaroteno y la tretinoína presentan beneficios sobre sus secuelas, como las cicatrices y la hiperpigmentación postinflamatoria, incluso en pacientes con fototipos altos, aunque los periodos de tratamiento deberán de ser prolongados12.
Los retinoides orales son los fármacos más eficaces en el tratamiento del acné severo, nódulo-quístico. Reducen la producción de sebo, evitan las resistencias antibióticas, descaman la piel desobstruyendo los folículos y reducen la inflamación en plazos tan cortos como 4 semanas. A pesar de que la inhibición de la producción de sebo, la apoptosis de los sebocitos, la reducción del tamaño de las glándulas sebáceas y de la hiperqueratinización folicular regresan a valores similares a los iniciales tras unos 4 meses de finalizar el tratamiento, la mejoría clínica se mantiene durante años, y suele ser más prolongada en función de la dosis acumulada. El mecanismo responsable podría ser la inhibición prolongada de la expresión de los receptores Toll‑like‑2 en los monocitos con la consiguiente modulación de la respuesta de la inmunidad innata13.
En la actualidad, las dosis diarias habituales oscilan de 0,5 a 1 mg/kg/día hasta lograr un 90% de mejoría respecto a la valoración inicial, con un periodo de consolidación de cuatro a ocho semanas. Normalmente se consigue con tratamiento de 20 semanas y dosis finales acumuladas de 120 a 150 mg/kg (dosis totales de 7.200-9.000 mg para una persona de 60 kg de peso)14. Sin embargo, en los últimos años se han acumulado evidencias sobre la efectividad empleando dosis inferiores15,16.
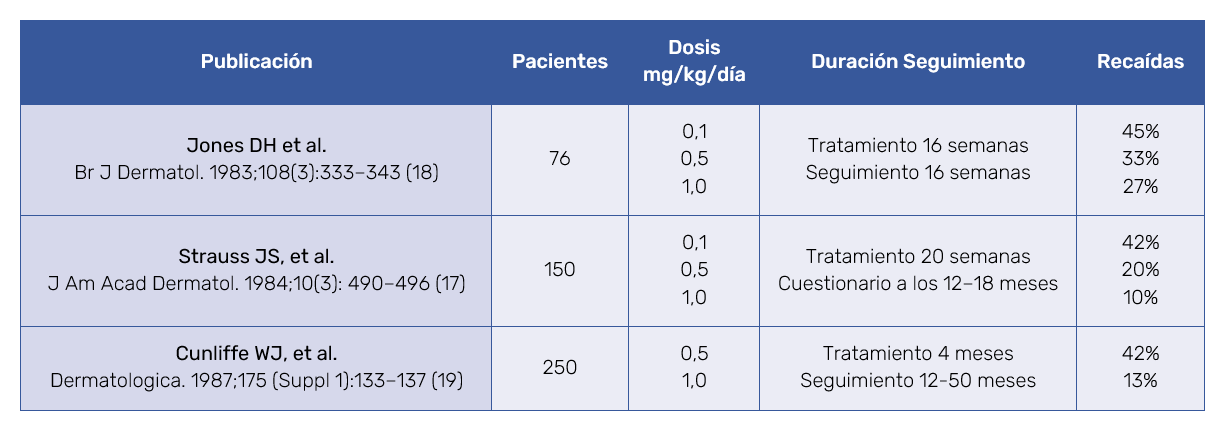
Cabe destacar que en los estudios dosis-respuesta se controlaron lesiones nódulo-quísticas de acné severo en el mismo periodo de tiempo a dosis de 0,1; 0,5 y 1 mg/kg sin diferencias clínicas significativas17. Sin embargo, estudios publicados han observado una clara influencia de las dosis totales al final del primer tratamiento en la incidencia de recaídas y necesidad de retratar con isotretinoína (Tabla I)17‑19.
El tratamiento del acné en Asia
Las singularidades del tratamiento del acné en la región surasiática fueron abordadas en un documento de consenso en 201520 que resaltó la elevada resistencia antibiótica del P. acnes. En Singapur, observaron resistencias del 69% para eritromicina y del 50% para clindamicina, comparados por ejemplo con cotrimoxazol (38%) y doxiciclina (23%). En el mundo, la resistencia antibiótica del P. acnes progresó del 20% en 1978 al 62% en 199621.
En Vietnam se han efectuado pocos estudios; el más reciente sobre la influencia de la isotretinoína en los niveles de ácido fólico y homocisteína y el riesgo de eventos cardiovasculares. En un estudio sobre 52 individuos, observaron que dosis inferiores a 0,5 mg/kg/día (media 0,37 mg/kg/día) controlaban el acné pero iban seguidas de una elevación significativa de los niveles de homocisteína en suero y de una disminución de los niveles de ácido fólico; si bien, dentro de los límites normales22.
Otro aspecto que preocupa a la población asiática es el cuidado de las secuelas postacné, tanto de la hiperpigmentación postinflamatoria (PIH) como del eritema postinflamatorio (PIE). Una población de 53 pacientes vietnamitas de edad media de 26 años y fototipos II‑IV, recibió cuatro sesiones de radiofrecuencia fraccionada (intervalo mensual) para el tratamiento de PIE y cicatrices atróficas, y presentó un 73% de mejoría del eritema en el tercer mes. Las cicatrices grado IV mejoraron del 73% al 25% en la escala de Goodman-Baron23.
El tratamiento del acné en una clínica internacional de Ho Chi Minh City
Durante siete años se ha tratado el acné en Vietnam con isotretinoína oral cuando era necesario. Las dosis de inicio fueron inferiores a las recomendadas en las guías en el 95% de casos1,2. Los motivos fueron la evidencia disponible en la literatura de una eficacia aceptable y mejor tolerancia con dosis inferiores15,16. Motivos adicionales fueron el temor de los pacientes a efectos secundarios metabólicos, psiquiátricos y por exposición solar. En las mujeres fértiles se ofreció anticoncepción y se informó de los riesgos fetales en caso de embarazo durante el tratamiento con isotretinoína, pero el rechazo de la anticoncepción no impidió la prescripción. Se efectuó una evaluación retrospectiva de las historias de pacientes que acudieron con diagnóstico de acné entre junio de 2013 y junio de 2019 con la intención de responder a las siguientes preguntas:
- ¿Cuáles son las características de la población que busca tratamiento del acné en una clínica internacional en Ho Chi Minh?
- ¿Pueden ser suficientes dosis bajas de retinoides orales solas o en combinación con tratamientos tópicos para controlar episodios de acné moderado-severo?
- ¿Es seguro el empleo de retinoides orales en un clima estival permanente?
- ¿Es necesario obligar a firmar un contrato de uso de retinoides y someter al paciente al uso de contraceptivos y pruebas de embarazo antes, durante y al acabar el tratamiento como recomiendan las guías?
- ¿Qué grado de satisfacción obtiene el paciente que ha sido tratado con dosis bajas de retinoides orales?
Material y método
Se revisaron las historias de los pacientes que se visitaron por acné entre los meses de junio de 2013 y 2019, así como todos los que adquirieron isotretinoína (Acnotín® 10 o 20 mg, Laboratorios Bagó) en la farmacia adscrita a la clínica. A los pacientes tratados con isotretinoína oral se les envió un cuestionario mediante correo electrónico donde se les preguntaba por la dosis diaria, dosis total, duración del tratamiento, efectos secundarios, tratamientos de mantenimiento, recidivas, secuelas y satisfacción. Se recogió el consentimiento informado para compartir la información clínica en la misma encuesta.
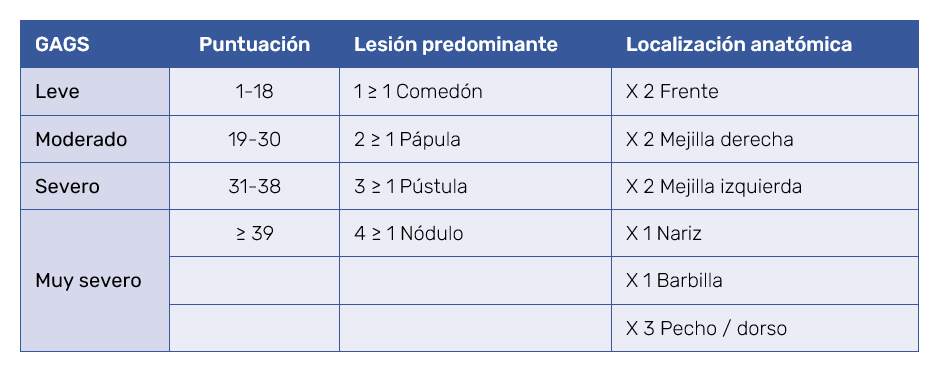
Se incluyeron pacientes de ambos sexos, de todas las edades, nacionalidades y etnias. Basados en los datos recogidos en las historias clínicas se efectuó una estimación cualitativa de la severidad del acné previa al tratamiento mediante la escala GAGS (Global Acne Grading Score) propuesta por Doshi et al24 (Tabla II) sobre el tipo predominante de lesiones y su localización tanto en los pacientes que recibieron tratamiento con retinoides tópicos como orales.
Se revisó la incidencia de efectos secundarios cutáneos, metabólicos y psíquicos cuando fue posible. Se descartaron los pacientes a los que se prescribió isotretinoína para otras patologías fuera de ficha técnica (rosácea, foliculitis, psoriasis).
Resultados
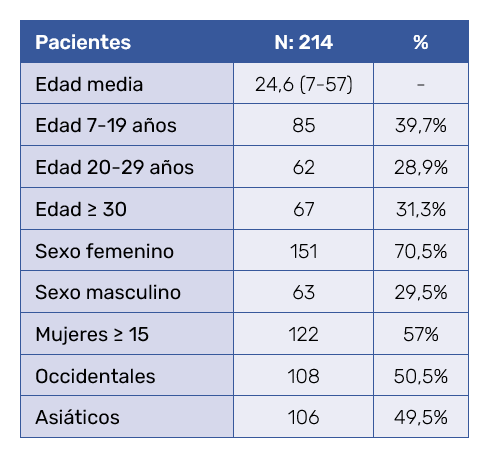
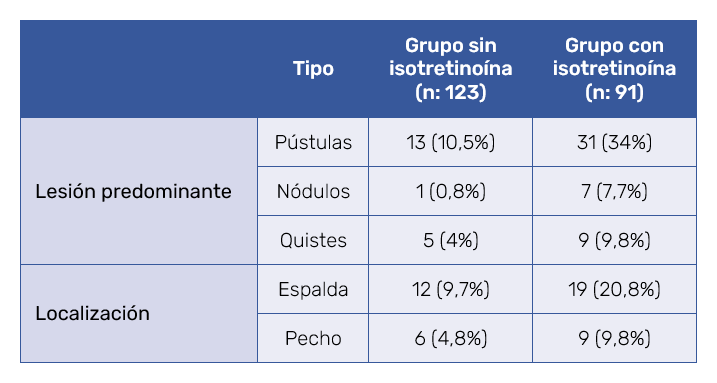
Se estudiaron 214 pacientes con acné, cuyos datos demográficos se muestran en la Tabla III. En cuanto al tipo de acné, predominaron en ambos grupos las lesiones mixtas de comedones y pápulas, con localización facial. Se recogieron los datos que mostraban inflamación y un peor pronóstico de los pacientes previamente al tratamiento con y sin isotretinoína, y se tuvieron en cuenta las lesiones cístico-nodulares y las localizaciones tronculares (Tabla IV).
En el grupo sin isotretinoína oral (n: 123) se estimó el GAGS al inicio en 106 pacientes en 86,1% y fue leve en el 73,5% de casos. En el grupo que recibió isotretinoína oral (n: 91) el GAGS en 78 pacientes fue 85,7%. Su GAGS al inicio fue moderado o severo en el 62,7% de los casos (Tabla V).
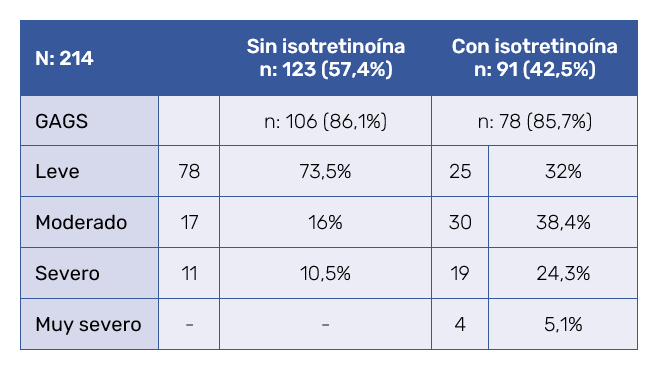
Ciento veintitrés pacientes (57,4%) recibieron tratamiento con retinoides tópicos y antibióticos, siendo la tretinoína sola o con eritromicina y el peróxido de benzoílo con adapaleno o tretinoína, las combinaciones tópicas más usadas. Se prescribieron antibióticos orales a 11 pacientes con predominio de lesiones inflamatorias. En este grupo sin isotretinoína oral, solo 15 pacientes acudieron a seguimiento tras la primera visita. Es decir, 107 pacientes (87,7%) no volvieron a la consulta. Cuando se comparó la procedencia de este singular grupo de “visita única” se observó que el 45,7% fueron asiáticos y el 54,2 de otras procedencias.
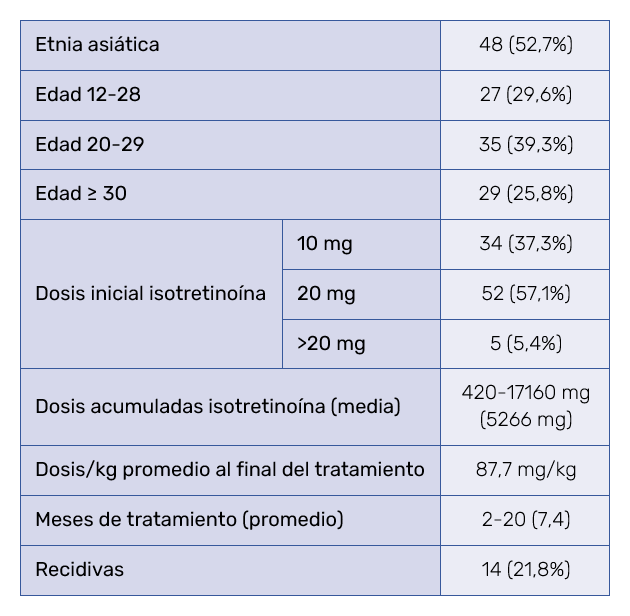
En el grupo de 91 pacientes (42,5%) que recibieron isotretinoína oral para su acné, 48 (52,7%) fueron asiáticos y 43 (47,2%) de otro origen, con edades de 12 a 57 años. De estos, 35 pacientes tenían entre 20 y 29 años (39,3%) y 23 fueron mayores de 29 años (25,8%). La dosis de inicio fue de 10 mg diarios en 34 (37,3%) pacientes, 20 mg en 52 (57,1%) pacientes y superior a 20 mg diarios en 5 pacientes (Tabla VI). La isotretinoína fue incrementada al doble de la dosis inicial en 8 pacientes (de 10 a 20 mg o de 20 a 40 mg) tras comprobar al cabo de un mes de tratamiento buena tolerancia y expresar los pacientes el deseo de mayor efectividad. Cincuenta y tres pacientes (58,2%) acudieron a consultas sucesivas, y 38 (41,7%) no volvieron. Sin embargo, 11 pacientes contestaron a las encuestas, por lo que se obtuvo información sobre 64 casos. En este grupo tratado con isotretinoína, el subgrupo que acudió a una única visita fue asiático en el 54%, y de otros orígenes en el 45,9%.
La duración del tratamiento con isotretinoína osciló entre 2 y 20 meses con una media de 7,4 meses. Debido a que ni la dosis inicial de isotretinoína ni los aumentos se basaron en el peso inicial de los pacientes, este dato no se recogió en la historia clínica. Sin embargo, se hizo una estimación promedio del peso de 60 kg, y en base a ello, al final del tratamiento las dosis totales de isotretinoína se estimaron entre 420 mg y 17.160 mg con un promedio de 5.266 mg, que equivale a dosis finales acumuladas de 87,7 mg/kg, por debajo de los 120‑150 mg/kg o de los 7.200-9.000 mg acumulados al final del tratamiento1,2. De todos los pacientes tratados, solo 8 pacientes alcanzaron o superaron los 7.200 mg acumulados (Tabla VI).
Se trataron 122 pacientes mujeres fértiles, a las que se ofreció tratamiento anticonceptivo con etinilestradiol-drospirenona (0,03 mg / 3 mg), cuando se recomendó isotretinoína oral. El 85,3% de este grupo rechazó el empleo de anticonceptivos, sin que hubiera embarazos no deseados durante el periodo de observación. El criterio para la finalización del tratamiento fue que no hubiera lesiones inflamatorias durante 4 a 8 semanas. El 58,2% de los pacientes del grupo tratado con isotretinoína acudió a seguimiento y fue dado de alta con retinoides tópicos o peróxido de benzoílo. Pese a ello, se informó de 14 casos con recidivas de acné (21,8%) en ese grupo. Los pacientes recidivados presentaron GAGS al inicio de 6 a 42, media de 20,8 ± 9,5. Todos ellos, excepto tres, habían recibido dosis totales de isotretinoína por debajo de 120 mg/kg. Las recidivas se produjeron en un intervalo de 2 a 11 meses postratamiento (media 2,3 meses).
Hubo 13 pacientes (20,3%) que comunicaron efectos secundarios con isotretinoína, la mayoría en forma de xerosis labial o facial. Se observó elevación transitoria de los niveles de colesterol en 3 casos y elevación de las transaminasas en un caso, que no obligaron a suspender el tratamiento. No se observó empeoramiento del acné en cuanto a mayor inflamación o número de lesiones durante el tratamiento. Los efectos secundarios fueron proporcionales a las dosis empleadas, con sequedad facial y labial como más frecuentes. No hubo fenómenos de hipersensibilidad solar o quemaduras, excepto en un caso, a pesar de vivir en una región donde el clima es estival los doce meses del año.
Satisfacción
Pese a dosis de isotretinoína al inicio de 10‑20 mg diarios, la percepción de mejora del acné, tanto de los pacientes como de los médicos fue elevada en periodos tan cortos como 4‑6 semanas, con mejoras del GAGS de un grado de severidad como mínimo y con una tolerancia excelente. La satisfacción subjetiva fue del 75% o superior en el 85% de los pacientes, incluso con la eventualidad de una recidiva del acné a los pocos meses.
Discusión
Desde hace 7 años se viene administrando isotretinoína oral a dosis inferiores a 0,5 mg/kg/día, habitualmente de 10 a 20 mg, con el ánimo de incrementar la tolerancia y el cumplimiento terapéutico. Algunos trabajos comparativos entre dosis convencionales e inferiores mostraron evidencias de que el uso de dosis bajas de isotretinoína no suponía un tratamiento más prolongado ni un retraso en la mejoría clínica o un incremento en las recidivas15,16,25. No obstante, otros trabajos observaron en los pacientes tratados con dosis acumuladas inferiores a 120‑150 mg/kg, un incremento de más del doble en las recidivas de acné en un plazo de 18 a 60 meses17‑19 (Tabla I). En esta casuística, la mejoría clínica ocurrió dentro de las primeras 4 a 6 semanas, incluso con dosis de 10 mg al día, lo que está bien descrito en la literatura14‑17.
En 2011, Lee JW et al16 estudiaron 60 pacientes con acné moderado y los randomizaron a isotretinoína 0,5‑0,7 mg/kg/día, 0,25‑0,4 mg/kg/día o isotretinoína 0,5‑0,7 mg/kg/día una semana cada cuatro. La duración del tratamiento fue de 24 semanas en los dos primeros grupos y de 6 semanas en el grupo de tratamiento intermitente. Al año de la finalización del tratamiento evaluaron el GAGS, número de lesiones inflamatorias y no inflamatorias y la satisfacción de los pacientes, y encontraron diferencias significativas entre los dos primeros grupos de tratamiento diario y el de tratamiento discontinuo, pero no entre el grupo de dosis convencionales y el de dosis reducidas. Las recidivas fueron comparables en los dos primeros grupos (12,5% y 17,6%) y muy superiores en el grupo de tratamiento discontinuo (56,2%)16. En este estudio, el acné recidivó en 14 casos (21,8%) en el intervalo de 2 a 11 meses postratamiento. En otros estudios contrastados, las recidivas ocurrieron en un rango variable del 4 a 61% de los casos según las series, hasta en el 20% de pacientes a los 5 años, incluso con tratamientos de 120‑150 mg/kg/día14,17‑19. En este sentido destaca el trabajo de Cyrulnik et al26 que trató a 80 pacientes con dosis acumuladas de 290 mg/kg y redujo las recidivas al 12,5%. No halló un incremento en los efectos secundarios ni un detrimento en los cuestionarios de calidad de vida26. Los 14 pacientes que sufrieron recidivas en nuestra serie tenían un GAGS medio de 22,8, y el 42,8% tenía historia prolongada de acné, lesiones de localización troncular y/o predominio de macrocomedones. Excepto 3, todos fueron tratados con dosis iniciales de 10 a 20 mg al día (dosis totales inferiores a los 120‑150 mg/kg). En la literatura se ha identificado como factores contributivos a las recidivas: edad de inicio (cuanto más jóvenes, peor), dosis acumulada en el primer tratamiento (cuanto menor, peor), exceso androgénico, presencia de macrocomedones, historia previa de otras patologías cutáneas (tales que quistes pilonidales o hidradenitis supurativa) y el cumplimiento terapéutico14. Otro aspecto importante es la influencia del estómago vacío, que no favorece la absorción gástrica y la consiguiente biodisponibilidad de la isotretinoína. Es posible que la dieta vietnamita, pobre en grasas y calorías, influya en una menor absorción de la isotretinoína, con un efecto acumulativo menor al final del tratamiento, si bien, cabe recordar que la mitad de la población tratada no era asiática. Al menos 10 pacientes comentaron que su acné comenzó, recidivó o se agravó tras su llegada a la ciudad de Ho Chi Minh. Un posible desencadenante podría ser el clima, con temperaturas medias de 28°C, alto grado de humedad y luz solar 12 horas al día todo el año. Ya se ha comentado la producción incrementada de porfirinas fotosensibilizantes por cepas inflamatorias de P. acnes6. En una serie de 100 casos de soldados que participaron en el Pacífico en la II Guerra Mundial, que habían sufrido acné leve en la adolescencia, presentaron lesiones nódulo-quísticas o granulomatosas, y de localización torácica o cervical en el 84% de los casos. Por ello, el autor denominó a este fenómeno, acné tropical27.
En 13 pacientes (20,3%) del grupo tratado con isotretinoína oral, se informó de efectos secundarios, la mitad en forma de xerosis cutánea o labial. Es una baja incidencia de efectos secundarios cutáneos en comparación con otros trabajos (43% incluso en pacientes tratados con dosis inferiores a 0,25 mg/kg/día)28, lo que puede ser debido a una subestimación por parte de los pacientes más que a diferencias raciales, pues solo el 52% era población asiática. Otra explicación pudiera ser el hecho de iniciar el tratamiento con dosis muy bajas (10 mg diarios en el 37,3% de los pacientes, y 20 mg diarios en el 57,1%). Resulta llamativa la ausencia de reacciones de fotosensibilidad salvo en un caso, lo que puede atribuirse a las bajas dosis, junto a una cultura de evitación solar en la población asiática.
Se registraron 2 casos de empeoramiento del acné durante el tratamiento, una paciente de 31 años, con GAGS 36 y dosis de 0,61 mg/kg/día, y otra de 33 años, GAGS de 42 y dosis de 0,71 mg/kg/día, ambas con macrocomedones. La evidencia indica que la isotretinoína a dosis de 0,5 a 1 mg/kg/día puede incrementar la inflamación en las lesiones del acné hasta el punto de requerir tratamiento con esteroides orales o subcutáneos. En la serie de Demircay, el 32% presentó un brote facial o en tronco en las primeras semanas (4,5% severo, 10% moderado y 18% leve). Como factores predictivos de brote severo se identificaron el sexo masculino, acné severo previo al tratamiento, GAGS superior a 28, la presencia de más de 44 comedones en cara y lesiones nodulares en el tronco29.
Borghi et al compararon, en un estudio prospectivo, un grupo de 132 adolescentes tratados con dosis iniciales de 0,2 mg/kg y aumentos de 5 mg semanales, con otro grupo previamente tratado con dosis mayores de 0,5 mg/kg. Los casos de empeoramiento (agravamiento superior al 30% respecto a la situación previa) fueron el 7,5% contra el 15% del grupo con dosis superiores. Parece claro que la severidad de los efectos secundarios cutáneos por isotretinoína es dosis dependiente, con un punto de corte que se acerca a los 0,5 mg/kg/día30.
A los pacientes tratados con isotretinoína suele recomendárseles seguir controles de sus enzimas hepáticos y lípidos plasmáticos. Sin embargo, un reciente metaanálisis sobre 26 estudios y una población de 1.574 pacientes tratados durante cuatro o más semanas con dosis diarias iguales o mayores de 40 mg no encontró suficientes evidencias para recomendar el análisis de enzimas hepáticos y lípidos de forma rutinaria en los tratamientos con isotretinoína, incluso en los que reciben dosis superiores a 0,5 mg/kg/día31. En la serie ya comentada de Amichai, menos del 5% de los pacientes presentaron alteraciones significativas de los lípidos o enzimas hepáticos19. En la serie presentada, dadas las bajas dosis de isotretinoína empleadas (inferior a 20 mg/día en el 95,6% de casos), solo se practicó control de los lípidos en el 10% de los casos. Dos pacientes tuvieron alterado el colesterol total, uno de ellos previamente al inicio del tratamiento.
El 85% de pacientes entrevistados mostró satisfacción del 75% o superior con el tratamiento, a pesar de sufrir efectos secundarios leves o recidivas. Creemos que el empleo de dosis bajas de isotretinoína con incrementos progresivos negociados con los pacientes convierten el manejo del acné en una experiencia más agradable/tolerable aún a pesar de la prolongación del tratamiento a periodos superiores a los seis meses.
Este trabajo presenta las limitaciones de ser retrospectivo, descriptivo, no planificado, ni aleatorizado. Aunque se valoró la severidad de las lesiones en la primera visita mediante una estimación retrospectiva de los datos de las historias clínicas a través de la escala de valoración cualitativa GAGS, no se dispone de evaluación fotográfica sistemática de su evolución o de sus secuelas.
El elevado número de pacientes que solo acudió a una única visita, en especial en el grupo no tratado con isotretinoína oral, ha impedido obtener conclusiones más robustas sobre la evolución a largo plazo. En una cohorte de más de 3.300 pacientes de todo el mundo, se resalta la baja adherencia al tratamiento, que no supera el 50% global, siendo peor en Europa (falta de adherencia del 58%) que en Asia (48%) o América (43%). El 46% de los pacientes que recibía isotretinoína mostró poca adherencia al tratamiento. Como factores correlacionados en el análisis multivariante hallaron la edad joven (menos de 15 años y de 15 a 25), la aparición de efectos secundarios, falta de información sobre la enfermedad, la falta de mejoría, ser evaluados por un médico generalista, tratamientos con isotretinoína previos, o la falta de satisfacción32. Cabe señalar que en Vietnam el acceso a la isotretinoína oral es libre, y al no estar controlado por prescripción médica, los pacientes pueden comprarla sin ningún tipo de restricción en las farmacias de la calle.
A pesar de las limitaciones, el estudio aporta la experiencia del tratamiento del acné en la práctica clínica diaria con dosis bajas de isotretinoína, en su mayoría de 10 a 20 mg al día, en una región tropical del sureste asiático. Así mismo, se ha tratado de dar respuesta a las preguntas que se formularon al realizar esta revisión.
Conclusiones
La población visitada durante 7 años en una clínica internacional en la ciudad de Ho Chi Minh fue de procedencia mixta, asiática y occidental casi a partes iguales, con un elevado porcentaje de pacientes mayores de 30 años.
Un gran número de pacientes solo consultó en una ocasión, lo que podría deberse al predominio de formas leves de acné (73%), a la disponibilidad de isotretinoína oral sin receta, o al esfuerzo económico que deben hacer los pacientes para ser visitados en una clínica privada.
La dosis de isotretinoína fue de 10 a 20 mg al día en el 95% de los pacientes, lo que permitió el control del acné en los pacientes que no respondieron a la primera línea de tratamiento tópica, con mejorías de GAGS de un grado de severidad o superior en 4 a 6 semanas en la mayoría de los casos. La isotretinoína se manifestó segura y bien tolerada, con mínimos casos de sequedad cutánea o fotosensibilidad, y escaso número de recidivas.
Declaración
El autor manifiesta no tener conflicto de intereses, y agradece al profesor Justo Miguel Alcolea López su apoyo y dirección para la redacción y publicación de este artículo, así como a la Sociedad Española de Medicina Estética.
Bibliografía
- Strauss JS, Krowchuk DP, Leyden JJ, Lucky AW, Shalita AR, Siegfried EC, et al. Guidelines of care for acne vulgaris management. J Am Acad Dermatol. 2007;56(4): 651‑663. https://doi.org/10.1016/j.jaad.2006.08.048
- Nast A, Dréno B, Bettoli V, Bukvic Mokos Z, Degitz K, Dressler C et al. European evidence-based (S3) guidelines for the treatment of acne. JEADV. 2012;26(Suppl 1):1‑29. https://doi.org/10.1111/jdv.13776
- Perkins AC, Cheng CE, Hillebrand GG, Miyamoto K, Kimball AB. Comparison of the epidemiology of acne vulgaris among Caucasian, Asian, Continental Indian and African American women. J Eur Acad Dermatol Venereol. 2011;25(9):1054‑1060. https://doi.org/10.1111/j.1468-3083.2010.03919.x
- Magin P, Pond D, Smith W, Watson A. A systematic review of the evidence for ‘myths and misconceptions’ in acne management: diet, face-washing and sunlight. Fam Pract. 2005;22(1):62‑70. https://doi.org/10.1093/fampra/cmh715
- Narang I, Sardana K, Bajpai R, Garg VK. Seasonal aggravation of acne in summers and the effect of temperature and humidity in a study in a tropical setting. J Cosmet Dermatol. 2019;18(4):1098‑1104. https://doi.org/10.1111/jocd.12777
- Johnson T, Kang D, Barnard E, Li H. Strain-Level Differences in Porphyrin Production and Regulation in Propionibacterium acnes Elucidate Disease Associations. mSphere. 2016;1(1):e00023‑15. Published 2016 Feb 10. https://doi.org/10.1128/mSphere.00023-15
- Bataille V, Snieder H, MacGregor AJ, Sasieni P, Spector TD. The influence of genetics and environmental factors in the pathogenesis of acne: a twin study of acne in women. J Invest Dermatol. 2002; 119(6):1317‑1322. https://doi.org/10.1046/j.1523-1747.2002.19621.x
- Kim J. Review of the innate immune response in acne vulgaris: activation of Toll‑like receptor 2 in acne triggers inflammatory cytokine responses. Dermatology. 2005;211(3):193‑198. https://doi.org/10.1159/000087011
- Elsaie ML. Hormonal treatment of acne vulgaris: an update. Clin Cosmet Investig Dermatol. 2016;9:241‑248. https://doi.org/10.2147/ccid.s114830
- Pelle E, McCarthy J, Seltmann H, Huang X, Mammone T, Zouboulis CC, et al. Identification of histamine receptors and reduction of squalene levels by an antihistamine in sebocytes. J Invest Dermatol. 2008;128(5):1280‑1285. https://doi.org/10.1038/sj.jid.5701160
- Leyden J, Stein-Gold L, Weiss J. Why Topical Retinoids Are Mainstay of Therapy for Acne. Dermatol Ther (Heidelb). 2017;7(3):293‑304. https://doi.org/10.1007/s13555-017-0185-2
- Grimes P, Callender V. Tazarotene cream for postinflammatory hyperpigmentation and acne vulgaris in darker skin: a double-blind, randomized, vehicle-controlled study. Cutis. 2006;77:45‑50.
- Dispenza MC, Wolpert EB, Gilliland KL, Dai JP, Cong Z, Nelson AM, et al. Systemic isotretinoin therapy normalizes exaggerated TLR‑2-mediated innate immune responses in acne patients. J Invest Dermatol. 2012;132:2198‑2205. https://doi.org/10.1038/jid.2012.111
- Del Rosso JQ. Face to face with oral isotretinoin: a closer look at the spectrum of therapeutic outcomes and why some patients need repeated courses. J Clin Aesthet Dermatol. 2012;5(11):17‑24.
- Amichai B, Shemer A, Grunwald MH. Low‑dose isotretinoin in the treatment of acne vulgaris. J Am Acad Dermatol. 2006;54(4):644‑646. https://doi.org/10.1016/j.jaad.2005.11.1061
- Lee JW, Yoo KH, Park KY, Han TY, Li K, Seo SJ, et al. Effectiveness of conventional, low‑dose and intermittent oral isotretinoin in the treatment of acne: a randomized, controlled comparative study. Br J Dermatol. 2011;164(6):1369‑1375. https://doi.org/10.1111/j.1365-2133.2010.10152.x
- Strauss JS, Rapini RP, Shalita AR, Konecky E, Pochi PE, Comite H, et al. Isotretinoin therapy for acne: results of a multicenter dose-response study. J Am Acad Dermatol. 1984;10(3):490‑496. https://doi.org/10.1016/s0190-9622(84)80100-0
- Cunliffe WJ, et al. Dermatologica. 1987;175 (Suppl 1):133‑13763.
- Jones DH, King K, Miller AJ, Cunliffe WJ. A dose-response study of 13‑cis-retinoic acid in acne vulgaris. Br J Dermatol. 1983;108(3):333‑343. https://doi.org/10.1111/j.1365-2133.1983.tb03973.x
- Goh CL, Abad‐Casintahan F, Aw DCW Baba R, Chan LC, Nguyen TH et al. South‐East Asia study alliance guidelines on the management of acne vulgaris in South‐East Asian patients. Journal of Dermatology 2015; 42: 945‑953. https://doi.org/10.1111/1346-8138.12993
- Ross JI, Snelling AM, Carnegie E, Coates P, Cunliffe WJ, Bettoli V et al. Antibiotic-resistant acne: lessons from Europe. Br J Dermatol 2003; 148: 467‑478. https://doi.org/10.1046/j.1365-2133.2003.05067.x
- Van THT, Minh PN, Thuy PTT, Gandolfi M, Satolli F, Feliciani C, et al. Efficacy of Oral Low‑Dose Isotretinoin in the Treatment of Acne Vulgaris in Vietnam. Open Access Maced J Med Sci. 2019 Jan 30; 7(2):279‑282.
- Kim CNT, Thi LP, Van TN, Minh PPT, Nguyet MV, Thi ML, et al. Successful Treatment of Facial Atrophic Acne Scars by Fractional Radiofrequency Microneedle in Vietnamese Patients. Open Access Maced J Med Sci. 2019;7(2):192‑194.
- Doshi A, Zaheer A, Stiller MJ. A comparison of current acne grading systems and proposal of a novel system. Int J Dermatol. 1997; 36(6):416‑418. https://doi.org/10.1046/j.1365-4362.1997.00099.x
- Lehucher-Ceyrac D, de La Salmonière P, Chastang C, Morel P. Predictive factors for failure of isotretinoin treatment in acne patients: results from a cohort of 237 patients. Dermatology. 1999;198(3):278‑283. https://doi.org/10.1159/000018130
- Cyrulnik AA, Viola KV, Gewirtzman AJ, Cohen SR. High‑dose isotretinoin in acne vulgaris: improved treatment outcomes and quality of life. Int J Dermatol. 2012;51(9):1123‑1130. https://doi.org/10.1111/j.1365-4632.2011.05409.x
- Novy FG. Tropical Acne. Calif Med. 1946 Dec; 65(6): 274‑277.
- Rademaker M. Adverse effects of isotretinoin: a retrospective review of 1743 patients started on isotretinoin. Australas J Dermatol. 2010;51:248‑53. https://doi.org/10.1111/j.1440-0960.2010.00657.x
- Demircay Z, Kus S, Sur H. Predictive factors for acne flare during isotretinoin treatment. Eur J Dermatol. 2008;18(4):452‑456.
- Borghi A, Mantovani L, Minghetti S, Virgili A, Bettoli A. Acute acne flare following isotretinoin administration: potential protective role of low starting dose. Dermatology. 2009;218(2):178‑180. https://doi.org/10.1159/000182270
- Lee YH, Scharnitz TP, Muscat J, Chen A, Gupta-Elera G, Kirby JS. Laboratory Monitoring During Isotretinoin Therapy for Acne: A Systematic Review and Meta-analysis. JAMA Dermatol 2016;152:35‑44. https://doi.org/10.1001/jamadermatol.2015.3091
- Dréno B, Thiboutot D, Gollnick H, Finlay AY, Layton A, Leyden JJ, et al. Large-scale worldwide observational study of adherence with acne therapy. Int J Dermatol 2010; 49: 448‑456. https://doi.org/10.1111/j.1365-4632.2010.04416.x

